- Кристаллические решетки
- Кристаллические решетки
- Урок 23. Химия 8 класс
- В данный момент вы не можете посмотреть или раздать видеоурок ученикам
- Получите невероятные возможности
- Конспект урока «Кристаллические решетки»
- Какая кристаллическая решетка у алмаза и в чем ее уникальность
- Строение кристалла и способ образования
- К какому типу относится кристаллическая решетка алмаза
- Физические и химические свойства
- Аллотропные модификации
- Способы применения вещества
- Получение искусственных минералов
Кристаллические решетки
Кристаллической решеткой называют пространственное расположение атомов или ионов в кристалле. Точки кристаллической решетки, в которых расположены атомы или ионы, называют узлами кристаллической решетки.
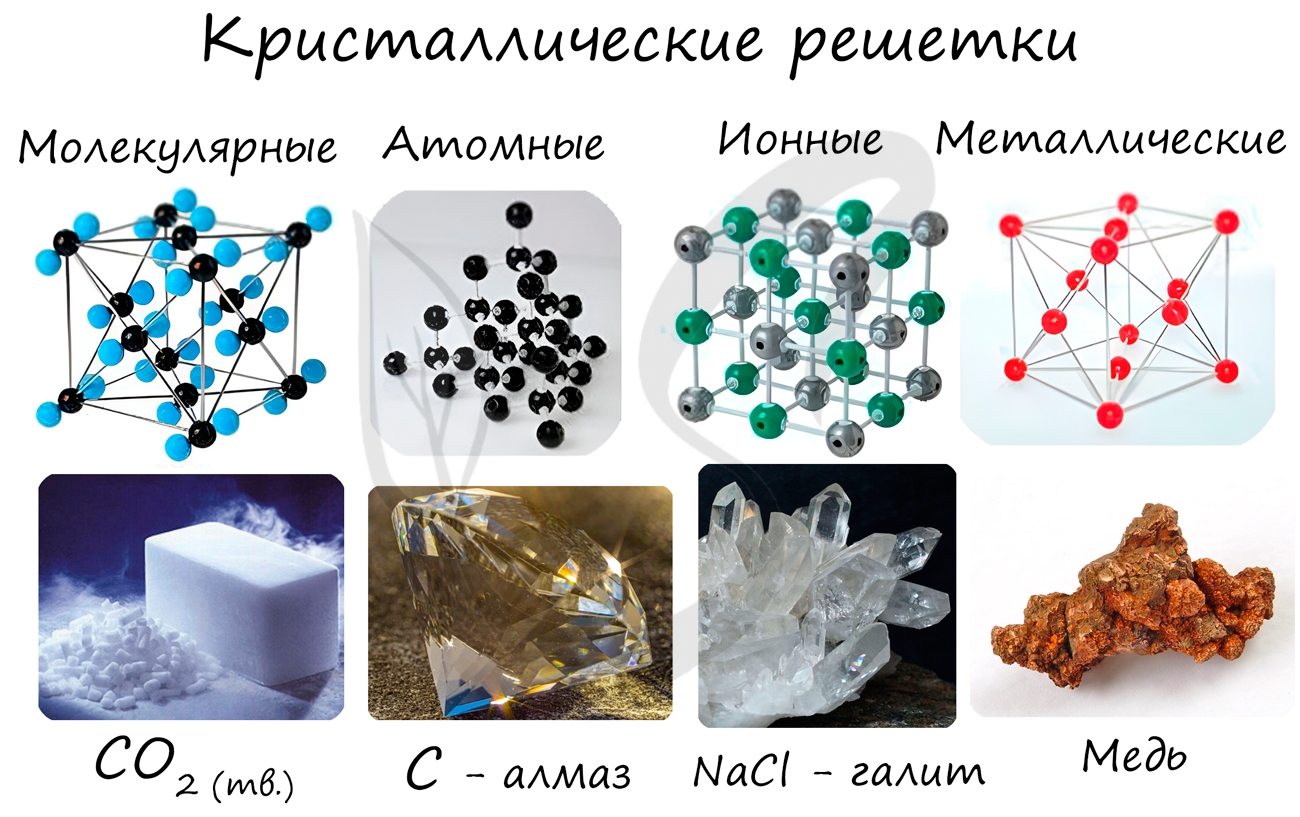
Кристаллические решетки подразделяют на молекулярные, атомные, ионные и металлические.
Очень важно не перепутать вид химической связи и кристаллической решетки. Помните, что кристаллические решетки отражают пространственное расположение атомов.
Молекулярная кристаллическая решетка
В узлах молекулярной решетки расположены молекулы. При обычных условиях молекулярную решетку имеют большинство газов и жидкостей. Связи чаще всего ковалентные полярные или неполярные.
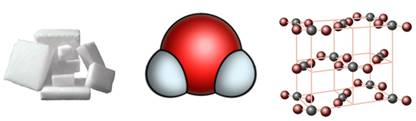
Классическим примером вещества с молекулярной решеткой является вода, так что ассоциируйте свойства этих веществ с водой. Вещества с молекулярной решеткой непрочные, имеют небольшую твердость, летучие, легкоплавкие, способны к возгонке, для них характерны небольшие температуры кипения.
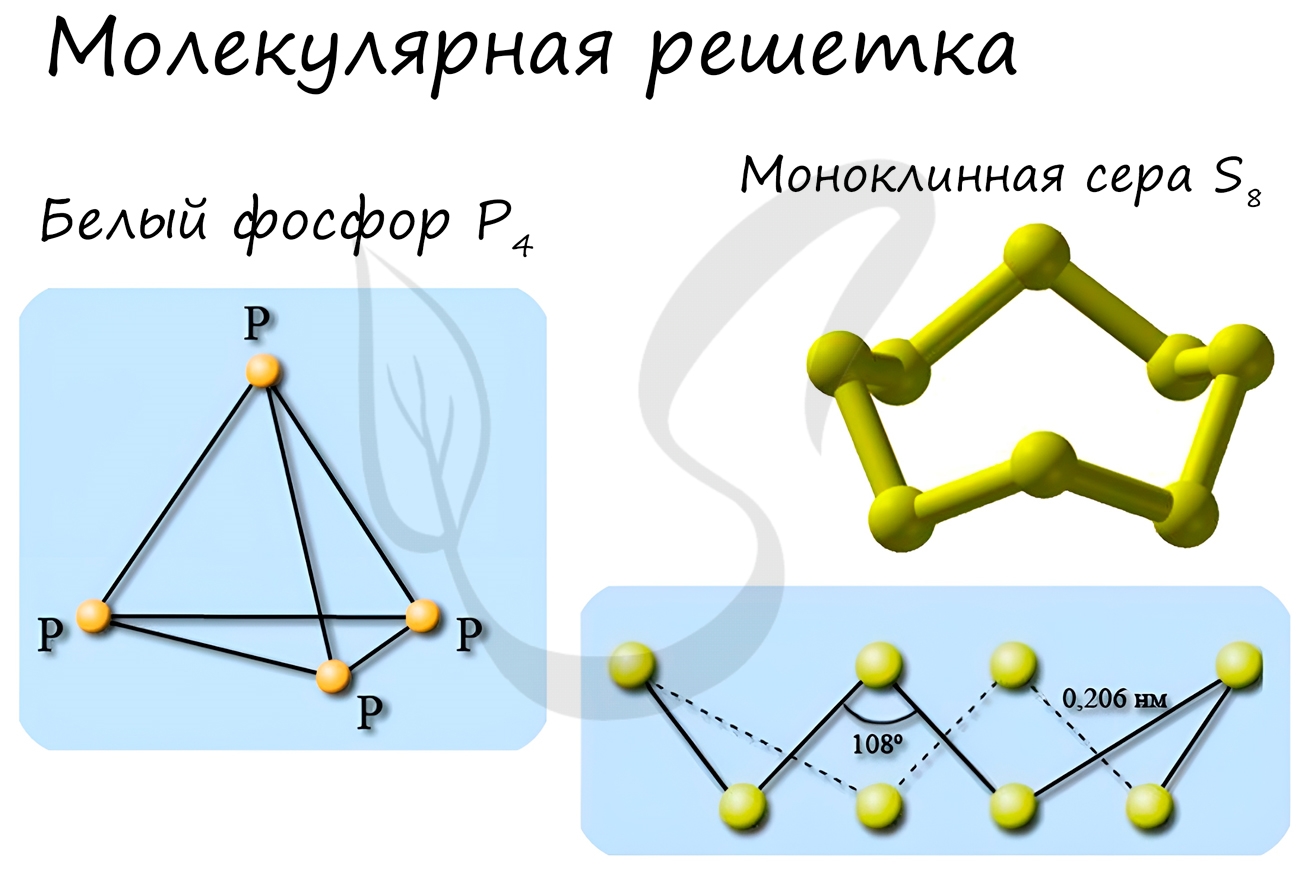
Примеры: NH3, H2O, Cl2, CO2, N2, Br2, H2, I2. Особо хочется отметить белый фосфор, ромбическую, пластическую и моноклинную серу, фуллерен. Эти аллотропные модификации мы подробно изучили в статье, посвященной классификации веществ.
Ионная кристаллическая решетка
В узлах ионной решетки находятся атомы, связанные ионной связью. Этот тип решетки характерен для веществ, обладающих ионной связь: соли, оксиды и гидроксиды металлов.
Ассоциируйте этот ряд веществ с поваренной солью — NaCl. Веществе с ионной решеткой имеют высокие температуры плавления и кипения, легко растворимы в воде, хрупкие, твердые, их растворы и расплавы проводят электрический ток.
Металлическая кристаллическая решетка
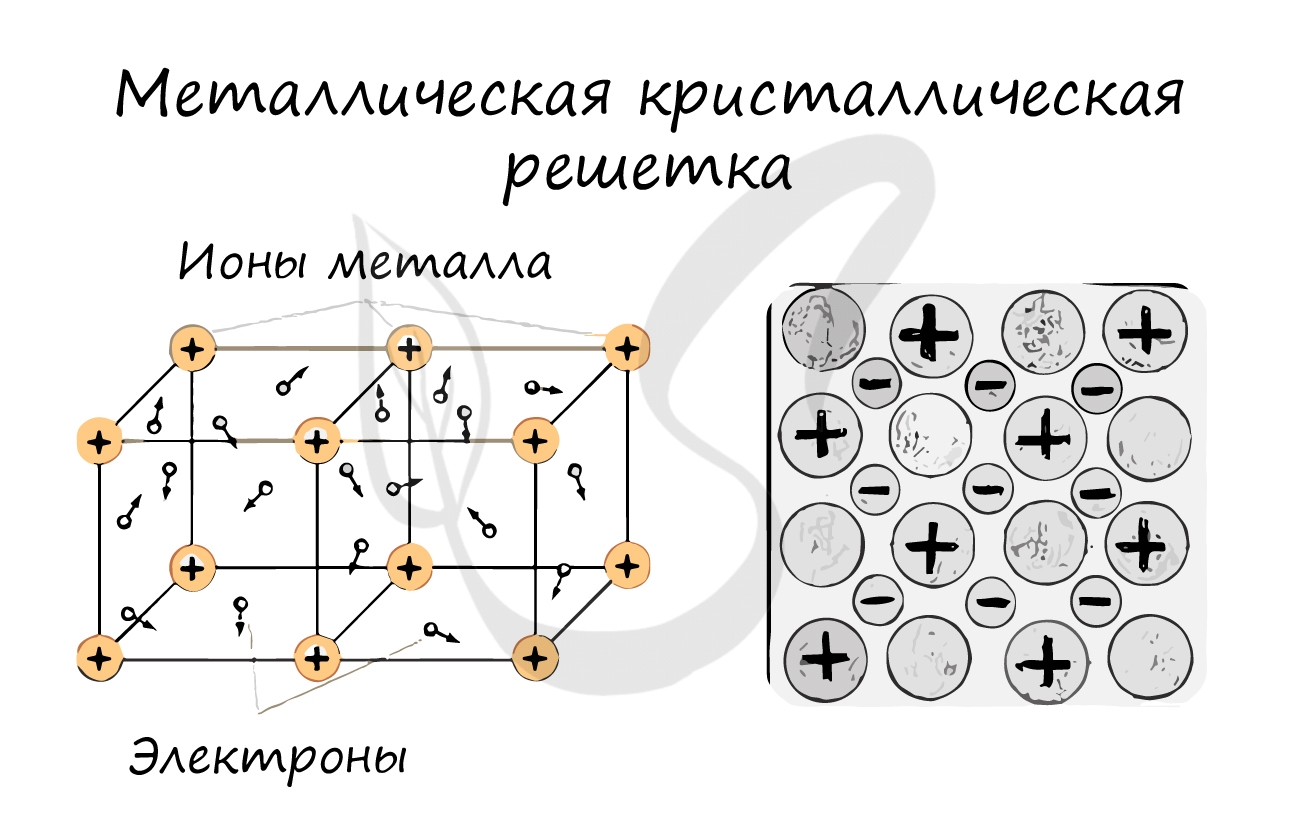
В узлах металлической решетки находятся атомы металла. Этот тип решетки характерен для веществ, образованных металлической связью.
Ассоциируйте свойства этих веществ с медью. Они обладают характерным металлическим блеском, ковкие и пластичные, хорошо проводят электрический ток и тепло, имеют высокие температуры плавления и кипения.
Примеры: Cu, Fe, Zn, Al, Cr, Mn.
Атомная кристаллическая решетка
В узлах атомной решетки находятся атомы, связанные ковалентной полярной или неполярной связью.
Ассоциируйте эти вещества с песком. Они очень твердые, очень тугоплавкие (высокая температура плавления), нелетучие, прочные, нерастворимы в воде.
Примеры: SiO2, B, Ge, SiC, Al2O3. Особенно хочется выделить: алмаз и графит (C), красный и черный фосфор (P).
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Кристаллические решетки
Урок 23. Химия 8 класс
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Кристаллические решетки»
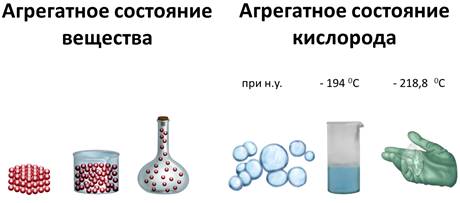
Вещество может существовать в трех агрегатных состояниях: газообразном, жидком, твёрдом. Например, кислород, является газом, но при температуре -194 0 С он превращается в голубую жидкость, а при температуре -218,8 0 С – затвердевает в снегообразную массу, состоящую из кристаллов синего цвета.
Твёрдые вещества делят на кристаллические и аморфные. Аморфные вещества не имеют четкой температуры плавления, при нагревании размягчаются и переходят в текучее состояние. К аморфным веществам относятся пластмассы, воск, шоколад, пластилин, жевательные резинки.
Кристаллические вещества состоят из частиц, которые имеют четкое расположение в определенных точках пространства. Если соединить эти частицы, то получится своеобразный каркас, который называется кристаллической решеткой. А точки, где находятся частицы – узлами кристаллической решетки. В узлах кристаллической решетки могут находиться ионы, атомы, молекулы. Эти частицы совершают колебательные движения. При повышении температуры размах этих колебаний увеличивается, что приводит к тепловому расширению тел.
В зависимости от типа частиц в кристаллической решетки и характера связи между ними, различают ионные, атомные, молекулярные и металлические кристаллические решётки.
Ионные кристаллические решётки
Ионными, называются кристаллические решётки, в узлах которых находятся ионы. Их образуют вещества с ионным типом связи. Это соли, основания, некоторые оксиды. Например, кристалл хлорида натрия, построен из чередующихся ионов Na + и Cl — . Они образуют решётку в виде куба. Связи в этом кристалле очень прочные, поэтому вещества с ионным типом связи имеют высокую твердость и прочность, они нелетучи и тугоплавки.
Атомные кристаллические решётки
Атомными называют кристаллические решётки, в узлах которых находятся отдельные атомы. Эти атомы между собой соединены очень прочными ковалентными связями. Атомную кристаллическую решётку имеет алмаз. Ограненный и отшлифованный алмаз называют бриллиантом. Он широко используется в ювелирном деле.
Кроме алмаза атомную кристаллическую решётку имеют и такие простые вещества, как бор, кремний, германий, и сложные: кремнезём, кварц, песок, горный хрусталь, в состав которых входит SiO2. Вещества с атомной кристаллической решеткой имеют высокие температуры плавления, они прочные и твёрдые, практически нерастворимые.
Молекулярные кристаллические решётки
Молекулярная кристаллическая решётка – это кристаллическая решетка, в узлах которой находятся молекулы. Связи у веществ с молекулярной кристаллической решёткой могут быть ковалентными полярными, как в молекулах HCl, H2O, и ковалентными неполярными, как в молекулах O2, O3, N2, H2 и др. Атомы внутри молекулы связаны прочно, а вот связи между самими молекулами непрочные. Поэтому вещества с молекулярной кристаллической решеткой имеют малую твердость, низкие температуры плавления и кипения, летучи. К веществам с молекулярной кристаллической решеткой относятся: лед (вода в твердом агрегатном состоянии), который уже при температуре выше 0 0 С переходит в жидкое состояние, его кристаллическая структура разрушается; твердый оксид углерода (IV) – «сухой лед», который возгоняется при увеличении температуры, т.е. превращается в газ, твёрдые хлороводород и сероводород, твёрдые простые вещества. Такие как, одноатомные благородные газы, двухатомные молекулы (O2, N2, H2, Cl2, I2), трёхатомные (O3), четырёхатомные, как Р4, восьмиатомные молекулы, как S8. Молекулярную кристаллическую решетку имеют большинство органических веществ: глюкоза, сахар, нафталин, спирт, лимонная кислота.
Металлические кристаллические решётки
Металлическую кристаллическую решётку имеют вещества с металлическим типом связи. В узлах этой кристаллической решетки находятся ионы металла и свободные электроны. Поэтому вещества с этим типом связи обладают ковкостью, пластичностью, имеют металлический блеск, электро- и теплопроводны.
Для веществ молекулярного строения справедлив закон французского химика Ж. Л. Пруста – закон постоянства состава: молекулярные химические соединения независимо от способа их получения имеют постоянный состав и свойства. Закон Пруста – основной из законов химии, однако он несправедлив для веществ немолекулярного строения.
Источник
Какая кристаллическая решетка у алмаза и в чем ее уникальность
Кристаллической решеткой алмаза ученые заинтересовались давно. Благодаря ее характеристикам, камень имеет особые свойства и ценность. Существуют аллотропные модификации, используемые в промышленности, электронике, медицине, космонавтике, авиации. В настоящее время развивается отрасль по созданию искусственных алмазов, но она требует больших затрат.
Строение кристалла и способ образования
Камень алмаз – кубическая аллотропная форма углерода, шестого элемента таблицы Менделеева. Образуется после сверхбыстрого охлаждения под действием сильного давления. Добывается в кимберлитовых трубках – вертикальных образованиях, возникших при прорыве магмы сквозь кору земли.
Под фразой «кристаллическая решетка алмаза» понимают пространственное расположение и соединения атомов углерода, обусловливающие твердость минерала.
По сути алмаз – это модификация углерода.
К какому типу относится кристаллическая решетка алмаза
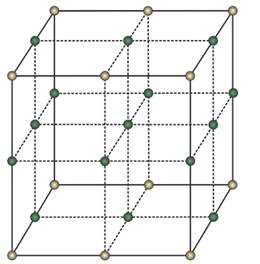
Минерал имеет атомную кристаллическую решетку, т. е. в узлах расположены атомы углероды.
Особенности строения кристаллической решетки алмаза обусловливают его прочность, т. к. каждый атом находится в центре тетраэдра (треугольная или трехгранная пирамида) и связан ковалентными связями. При этом каждый атом плотно связан с четырьмя соседними атомами.
Для алмаза характерна кубическая сингония, т. е. элементарная ячейка представлена в форме куба.
Строение кристаллической решетки алмаза:
- по одному атому углерода – на вершинах куба;
- по одному атому – в каждой грани;
- четыре атома – внутри куба.
Атомы, расположенные в центре граней – общие для двух ячеек. Атомы, расположенные на вершинах – общие для восьми ячеек. Между собой они соединены наиболее прочным подвидом ковалентной связи – сигма-связью.
Всего химики выделяют 4 типа связи атомов между собой:
Последний тип связи, формирующий кристаллическую решетку у алмаза, считается самым прочным.
Не все алмазы состоят исключительно из углерода. Иногда в составе встречаются посторонние примеси (кальций, алюминий, бор, магний, кремний, гранит, газы). Если примеси расположены поверхностно, то их можно удалить при огранке. Если же внутри камня, то такие алмазы не представляют ювелирной ценности и используются в промышленности.
Пример кристаллической решетки камня в видео:
Физические и химические свойства
Химическая формула минерала – C. Кристалл хорошо проводит тепло, но не проводит (или слабо проводит) электрический ток. Имеет хорошие преломляющие и отражающие свойства.
Плавится при температуре свыше 3700 градусов. Горит в сочетании с кислородом при температуре более 721 градуса. Устойчив к кислотам и щелочам.
- Цвет: бесцветный, прозрачный. Возможны оттенки голубого, желтого, синего, розового, красного, бурого, черного.
- Форма: кристалл с разным количеством граней.
- Блеск: сильный алмазный.
- Плотность: 3,5 г/см3.
- Твердость: абсолютная, 10 баллов. Но при этом камень очень хрупкий.
- Спайность: средняя.
- Электропроводность: слабая или отсутствует.
- Люминесцирует при ультрафиолете.
- Под действием рентгеновского излучения снижается прочность связей.
Аллотропные модификации
Некоторые другие химические элементы имеют схожую с алмазом структуру, но несколько отличную молекулярную кристаллическую решетку. Различие – в расположении атомов.
У алмаза атомы углерода располагаются близко друг другу. А у других элементов с большей атомной массой – расстояние между атомами больше, что снижает их прочность.
Из аллотропных модификаций известны:
- Лонсдейлиты – недостаточно изучены, добываются из метеоритов или создаются искусственно, имеют гексагональную кристаллическую решетку.
- Графит – имеет похожее строение, но отличается пи-связями и наличием свободных электронов (гексагональная кристаллическая решетка).
- Уголь – используется как сырье для получения тепла.
- Карбин – мелкие черные кристаллы в форме порошка, искусственно созданные.
- Фуллерены – кристаллическая решетка выглядит в виде мяча, собранного из восьмиугольников, искусственно созданные.
- Углеродные нанотрубки – используются как каркас к наноизделиям.
Аллотропные модификации способны к трансформации: под действием температуры 1800 градусов они преобразуются в графит.
Дополнительно смотрите видеоматериал об аллотропных формах углерода — алмазе и графите:
Способы применения вещества
Обработанные и ограненные камни высокого качества – бриллианты с идеальной кристаллической решеткой и составом (без примесей и дефектов) – используют для производства ювелирных украшений. Это наиболее прибыльная сфера применения минерала.
Дефектные камни идут на другие нужды:
- производство подшипников, сверл;
- использование в электронике и телекоммуникациях;
- изготовление механизмов из алмазного порошка;
- обрамление шлифовочных кругов;
- создание оптических линз;
- использование в качестве абразивов;
- создание квантовых компьютеров;
- применение в ядерной энергетике;
- изготовление медицинского инструментария.
Получение искусственных минералов
В настоящее время разработаны методики получения алмаза из графита.
По HPHT методу, формирование искусственного камня достигается воздействием 3000-градусной температуры при давлении более 1000 Па и добавлением металлов. Это приводит к изменению ковалентных связей в кристаллической решетке и образованию пористых мутных камней.
Но считается, что лучший способ получения искусственных самоцветов – это выращивание при температуре 1500 градусов. Но это затратный метод, как и создание алмазов с помощью ультразвука. Поэтому принято получать камни из паров метана. Метод основан на пленочном осаждении графита.
Технологии неуклонно развиваются, и возможно в скором будущем, ученые научатся синтезировать искусственные алмазы при минимальных затратах.
Может быть, вам известны еще какие-то особенности строения или получения алмазов? Поделитесь своими знаниями в комментариях. Делайте репост в соцсети.
Источник