- § 14. График плавления и отвердевания кристаллических тел
- Вопросы
- Задание
- Это любопытно.
- График плавления
- Переход из твердого состояния в жидкое
- График плавления льда
- Основные агрегатные состояния вещества
- Агрегатные состояния вещества
- Твердое состояние
- Жидкое состояние
- Газообразное состояние
- Фазовые переходы: изменение агрегатных состояний вещества
- График фазовых переходов
- Решение задач по фазовым переходам
- Сублимация и десублимация
- Влажность воздуха: испарение и конденсация
- Как влажность влияет на человека
§ 14. График плавления и отвердевания кристаллических тел
Плавление кристаллического тела — сложный процесс. Для его изучения рассмотрим график зависимости температуры кристаллического тела (льда) от времени его нагревания (рис. 18). На нём по горизонтальной оси отложено время, а по вертикальной — температура льда.
Рис. 18. График зависимости температуры льда от времени нагревания
Из графика видно, что наблюдение за процессом началось с момента, когда температура льда была -40 °С. При дальнейшем нагревании температура льда росла. На графике это участок АВ. Увеличение температуры происходило до 0 °С — температуры плавления льда. При 0 °С лёд начал плавиться, а его температура перестала расти. В течение всего времени плавления температура льда не менялась, хотя горелка продолжала гореть. Этому процессу соответствует горизонтальный участок графика — ВС.
После того как весь лёд расплавился и превратился в воду, температура снова стала подниматься (участок CD). Когда температура достигла +40 °С (точка D), горелка была погашена. Как видно из графика, температура воды после этого начала снижаться (участок DE). Вода стала охлаждаться. Когда её температура упала до 0 °С, начался процесс отвердевания воды — её кристаллизация, и пока вся вода не отвердеет, температура её не изменится (участок EF). Лишь после этого температура твёрдой воды — льда стала уменьшаться (участок FK).
Вопросы
- Пользуясь графиком (см. рис. 18) и текстом, относящимся к нему, объясните, что происходит с водой в отрезки времени, соответствующие каждому из участков графика.
- Как по графику можно судить об изменении температуры вещества при нагревании и охлаждении?
- Какие участки графика соответствуют плавлению и отвердеванию льда? Почему эти участки параллельны оси времени?
Задание
Начертите график плавления меди. По вертикали отложите температуру (1 клетка — 20 °С), а по горизонтали — время (1 клетка — 10 мин). Начальная температура меди равна 1000 °С, время нагревания до температуры плавления 20 мин, время перехода меди в жидкое состояние 30 мин.
Это любопытно.
Аморфные тела. Плавление аморфных тел
Существует особый вид тел, который принято также называть твёрдыми телами. Это аморфные тела. В естественных условиях они не обладают правильной геометрической формой.
К аморфным телам относятся: твёрдая смола (вар, канифоль), стекло, сургуч, эбонит, различные пластмассы.
По многим физическим свойствам, да и по внутреннему строению аморфные тела стоят ближе к жидкостям, чем к твёрдым телам.
Кусок твёрдой смолы от удара рассыпается на осколки, т. е. ведёт себя как хрупкое тело, но вместе с тем обнаруживает и свойства, присущие жидкостям. Твёрдые куски смолы, например, медленно растекаются по горизонтальной поверхности, а находясь в сосуде, со временем принимают его форму. По описанным свойствам твёрдую смолу можно рассматривать как очень густую и вязкую жидкость.
Аморфное тело — смола
Стекло обладает значительной прочностью и твёрдостью, т. е. свойствами, характерными для твёрдого тела. Однако стекло, хотя и очень медленно, способно течь, как смола.
В отличие от кристаллических тел, в аморфных телах атомы или молекулы расположены беспорядочно, как в жидкостях.
Кристаллические твёрдые тела, как мы видели (см. рис. 18), плавятся и отвердевают при одной и той же строго определённой для каждого вещества температуре. Иначе ведут себя аморфные вещества, например смола, воск, стекло. При нагревании они постепенно размягчаются, разжижаются и, наконец, превращаются в жидкость. Температура их при этом изменяется непрерывно. При отвердевании аморфных тел температура их также понижается непрерывно.
В аморфных твёрдых телах, как и в жидкостях, молекулы могут свободно перемещаться друг относительно друга. При нагревании аморфного тела скорость движения молекул увеличивается, увеличиваются расстояния между молекулами, а связи между ними ослабевают. В результате аморфное тело размягчается, становится текучим.
Зная строение аморфных тел, можно создавать материалы с заданными свойствами. В последние годы аморфные тела находят широкое применение при производстве считывающих головок аудио- и видеомагнитофонов, устройств записи и хранения информации в компьютерной технике, магнитных экранов и др.
Источник
График плавления
Одно и тоже вещество в реальном мире в зависимости от окружающих условий может находиться в различных состояниях. Например, вода может быть в виде жидкости, в идее твердого тела – лед, в виде газа – водяной пар.
- Эти состояния называются агрегатными состояниями вещества.
Молекулы вещества в различных агрегатных состояниях ничем не отличаются друг от друга. Конкретное агрегатное состояние определяется расположением молекул, а так же характером их движения и взаимодействия между собой.
Газ – расстояние между молекулами значительно больше размеров самих молекул. Молекулы в жидкости и в твердом теле расположены достаточно близко друг к другу. В твердых телах еще ближе.
Чтобы изменить агрегатное состояние тела, ему необходимо сообщить некоторую энергию. Например, чтобы перевести воду в пар её надо нагреть.Чтобы пар снова стал водой, он должен отдать энергию.
Переход из твердого состояния в жидкое
Переход вещества из твердого состояние в жидкое называется плавлением. Для того чтобы тело начало плавиться, его необходимо нагреть до определенной температуры. Температура, при которой вещество плавится, называют температурой плавления вещества.
Каждое вещество имеет свою температуру плавления. У каких-то тел она очень низкая, например, у льда. А у каких-то тел температура плавления очень высокая, например, железо. Вообще, плавление кристаллического тела это сложный процесс.
График плавления льда
Ниже на рисунке представлен график плавления кристаллического тела, в данном случае льда.
- График показывает зависимость температуры льда от времени, которое его нагревают. На вертикально оси отложена температура, по горизонтальной — время.
Из графика, что изначально температура льда была -20 градусов. Потом его начали нагревать. Температура начала расти. Участок АВ это участок нагревания льда. С течением времени, температура увеличилась до 0 градусов. Эта температура считается температурой плавления льда. При этой температуре лед начал плавиться, но при этом перестала возрастать его температура, хотя при этом лед также продолжали нагревать. Участку плавления соответствует участок ВС на графике.
Затем, когда весь лед расплавился и превратился в жидкость, температура воды снова стала увеличиваться. Это показано на графике лучом C. То есть делаем вывод, что во время плавления температура тела не изменяется, вся поступающая энергия идет на плвление.
Источник
Основные агрегатные состояния вещества
О чем эта статья:
Агрегатные состояния вещества
Чтобы разобраться с тем, какими бывают агрегатные состояния, предлагаю по ходу чтения статьи заполнять таблицу.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
Лед, вода и водяной пар — это все три агрегатных состояния одного вещества. Лед — твердое состояние, вода — жидкая, пар — газообразное. Для каждого вещества существует три состояния.
Твердое состояние
Его очень легко представить — это любой предмет, который мы встречаем в жизни. В этом состоянии тело сохраняет форму и объем. Расстояние между молекулами, приблизительно равно размеру самих молекул, которые, в свою очередь, расположены очень структурированно.
Такая структура называется кристаллической решеткой — из-за четкой структуры молекулам сложно двигаться, и они просто колеблются около своих положений.
Заполняем нашу табличку
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
Жидкое состояние
В этом состоянии сохраняется объем, но не сохраняется форма. Например, если перелить молоко из кувшина в стакан, то молоко, имевшее форму кувшина, примет форму стакана. Кстати, в корове у молока тоже была другая форма.

Расстояние между молекулами в жидком состоянии чуть больше, чем в твердом, но все равно невелико. При этом частицы не собраны в кристаллическую решетку, а расположены хаотично. Молекулы почти не двигаются, но при нагревании жидкости делают это более охотно.
Вспомните, что происходит, если залить чайный пакетик холодной водой — он почти не заваривается. А вот если налить кипяточку — чай точно будет готов.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
близко друг к другу
малоподвижны, при нагревании скорость движения молекул увеличивается
Газообразное состояние
В жизни мы встречаем газообразное состояние вещества, когда чувствуем запахи. Запах очень легко распространяется, потому что газ не имеет ни формы, ни объема (он занимает весь предоставленный ему объем), состоит из хаотично движущихся молекул, расстояние между которыми больше, чем размеры молекул.
Агрегатные состояния
Свойства
Расположение молекул
Расстояние между молекулами
Движение молекулы
сохраняет форму и объем
в кристаллической решетке
соотносится с размером молекул
колеблется около своего положения в кристаллической решетке
близко друг к другу
малоподвижны, при нагревании скорость движения молекул увеличивается
занимают предоставленный объем
больше размеров молекул
хаотичное и непрерывное
С агрегатными состояниями разобрались, ура! Но до сих пор неясно, каким образом у каждого вещества их целых три, и как одно переходит в другое. Для этого узнаем, что такое фазовые переходы.
Фазовые переходы: изменение агрегатных состояний вещества
При изменении внешних условий (например, если внутренняя энергия тела увеличивается или уменьшается в результате нагревания или охлаждения) могут происходить фазовые переходы — изменения агрегатных состояний вещества.
Фазовые переходы интересны тем, что все живое не Земле существует лишь благодаря тому, что вода умеет превращаться в лед или пар. С кристаллизацией, плавлением, парообразованием и конденсацией связаны многие процессы металлургии и микроэлектроники.
На схеме — названия всех фазовых переходов:

Переход из твердого состояния в жидкое — плавление;
Переход из жидкого состояния в твердое — кристаллизация;
Переход из газообразного состояния в жидкое — конденсация;
Переход из жидкого состояния в газообразное — парообразование;
Переход из твердого состояния в газообразное, минуя жидкое — сублимация;
Переход из газообразного состояния в твердое, минуя жидкое — десублимация.
График фазовых переходов
Если взять процесс превращения льда в воду, воды — в пар, и обратные действия, то мы получим очень информативный график.
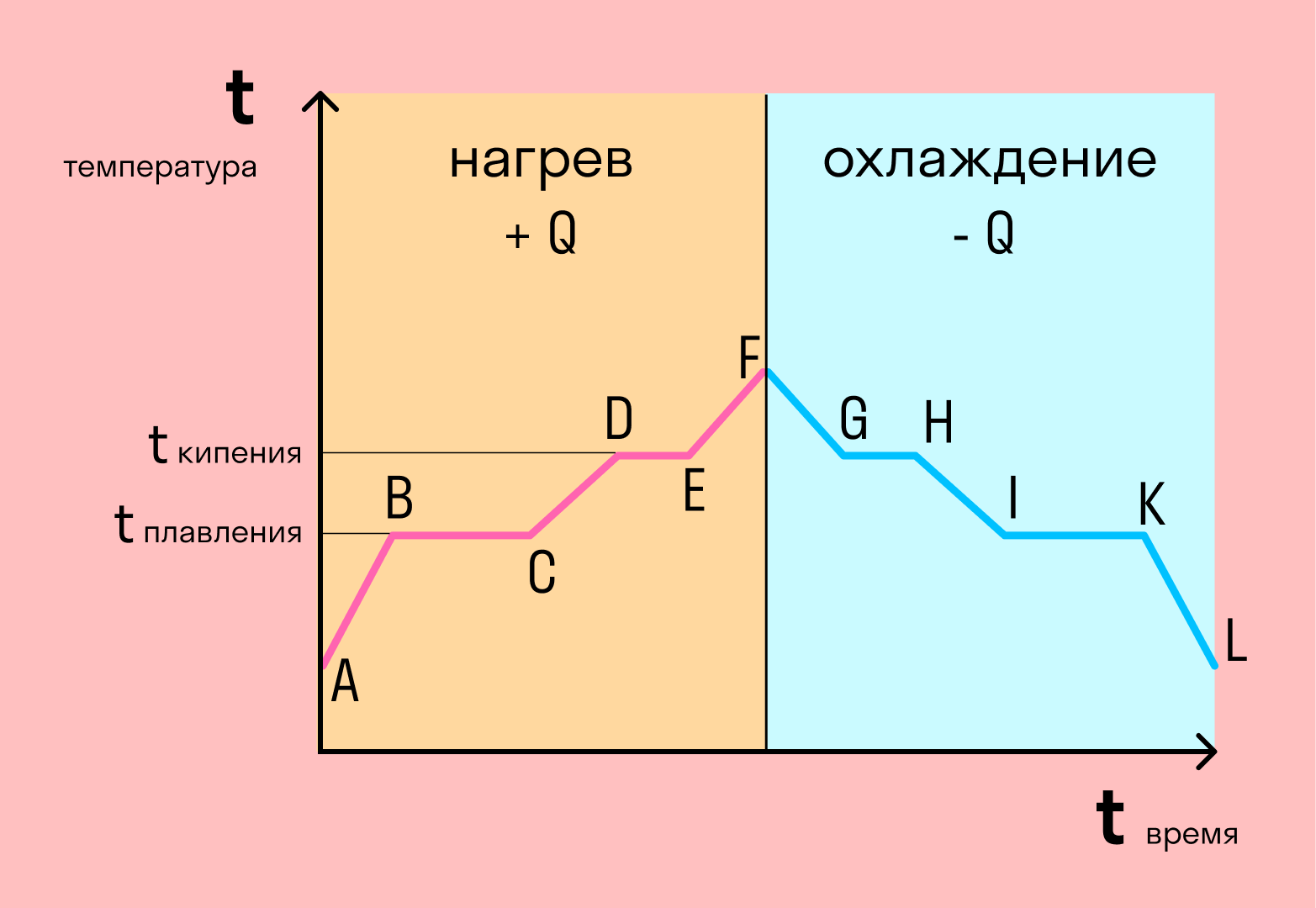
Разбираемся по шагам. Сначала взяли лед, конечно, при отрицательной температуре, потому что при нуле лед начинает плавиться. Нагрели лед до температуры плавления (до 0 градусов).
- AB — нагревание льда
После того, как лед нагрелся до температуры плавления, он начинает плавиться. Плавление происходит при постоянной температуре тем дольше длится, чем больше масса плавящегося вещества. Еще этот процесс зависит от свойств самого вещества, но об этом немного позже.
- BC — плавление льда
Расправившись вещество уже в жидком состоянии снова начинает нагреваться, и температура увеличивается, пока не достигает температуры кипения. В данном случае нагревается вода — это значит, что ее температура кипения равна 100 градусам Цельсия.
- CD — нагревание воды
При 100 градусах вода кипит, пока не выкипит целиком. В данном случае процесс аналогично плавлению происходит при постоянной температуре. Данный процесс нельзя путать с испарением, потому что парообразование происходит при конкретной температуре, а испарение — при любой.
- DE — кипение (парообразование) воды
Далее полученный пар нагревается, но путем нагревания невозможно дойти до другого фазового перехода — можно пойти только обратно.
- EF — нагревание пара
Первый шаг в обратную сторону — охлаждение до температуры кипения.
- FG — охлаждение пара
Дойдя до температуры кипения (в данном случае 100 градусов), пар начинает переходить в жидкое состояние. Этот процесс также происходит при постоянной температуре.
- GH — конденсация пара
Сконденсировавшись, вода охлаждается, пока не начнет замерзать.
- HI — охлаждение воды
Кристаллизуется (замерзает) вода при той же температуре, что и плавится лед — 0 градусов. Кристаллизация также происходит при постоянной температуре.
- IK — кристаллизация воды
После кристаллизации лед охлаждается.
- KL — охлаждение льда
С нагреванием и охлаждением все совсем просто — мы либо передаем теплоту телу (веществу), и оно идет на увеличение температуры, либо тело отдает тепло и охлаждается.
В остальных процессах температура не меняется. Это связано с тем, что количество теплоты не всегда зависит от температуры. Формулы для всех процессов выглядят так:
Нагревание
Охлаждение
Q — количество теплоты [Дж]
c — удельная теплоемкость вещества [Дж/кг*˚C]
m — масса [кг]
tконечная — конечная температура [˚C]
tначальная — начальная температура [˚C]
Плавление
Кристаллизация
Q — количество теплоты [Дж]
λ — удельная теплота плавления вещества [Дж/кг]
m — масса [кг]
Парообразование
Конденсация
Q — количество теплоты [Дж]
L — удельная теплота парообразования вещества [Дж/кг]
m — масса [кг]
Решение задач по фазовым переходам
С теорией разобрались — а теперь давайте практиковаться!
Задачка раз. Температура медного образца массой 100 г повысилась с 20 °С до 60 °С. Какое количество теплоты получил образец? Удельную теплоёмкость меди считать равной 380 Дж/(кг умножить на °С)
Сначала нужно перевести массу в килограммы:
Берем формулу количества теплоты для нагревания вещества:
Q = 380 * 0,1*(60-20) = 1520 Дж
Ответ: образец получил 1520 Дж
Задачка два. Какое количество теплоты необходимо для плавления 2,5 т стали, взятой при температуре плавления? Удельная теплота плавления стали λ=80кДж/кг. Теплопотерями пренебречь.
Сначала нужно перевести массу в килограммы и удельную теплоту в Дж/кг:
80 кДж/кг = 80000 Дж/кг
Берем формулу количества теплоты для плавления вещества:
Q = 80000*2500 = 200 000 000 Дж = 200 МДж
Ответ: для плавления 2,5 т стали необходимо 200 МДж теплоты.
Сублимация и десублимация
Мы уже рассказали про такие процессы, как сублимация и десублимация.
- Переход из твердого состояния в газообразное, минуя жидкое — сублимация (возгонка);
- Переход из газообразного состояния в твердое, минуя жидкое — десублимация.











