Кристаллический лед что это
Лёд — минерал с хим. формулой H2O , представляет собой воду в кристаллическом состоянии.
Химический состав льда: Н — 11,2%, О — 88,8%. Иногда содержит газообразные и твердые механические примеси.
В природе лёд представлен, главным образом, одной из нескольких кристаллических модификаций, устойчивой в интервале температур от 0 до 80°C, имеющей точку плавления 0°С. Известны 10 кристаллических модификаций льда и аморфный лёд. Наиболее изученным является лёд 1-й модификации — единственная модификация, обнаруженная в природе. Лёд встречается в природе в виде собственно льда (материкового, плавающего, подземного и др.), а также в виде снега, инея и т.д.
Смотрите так же:
СТРУКТУРА
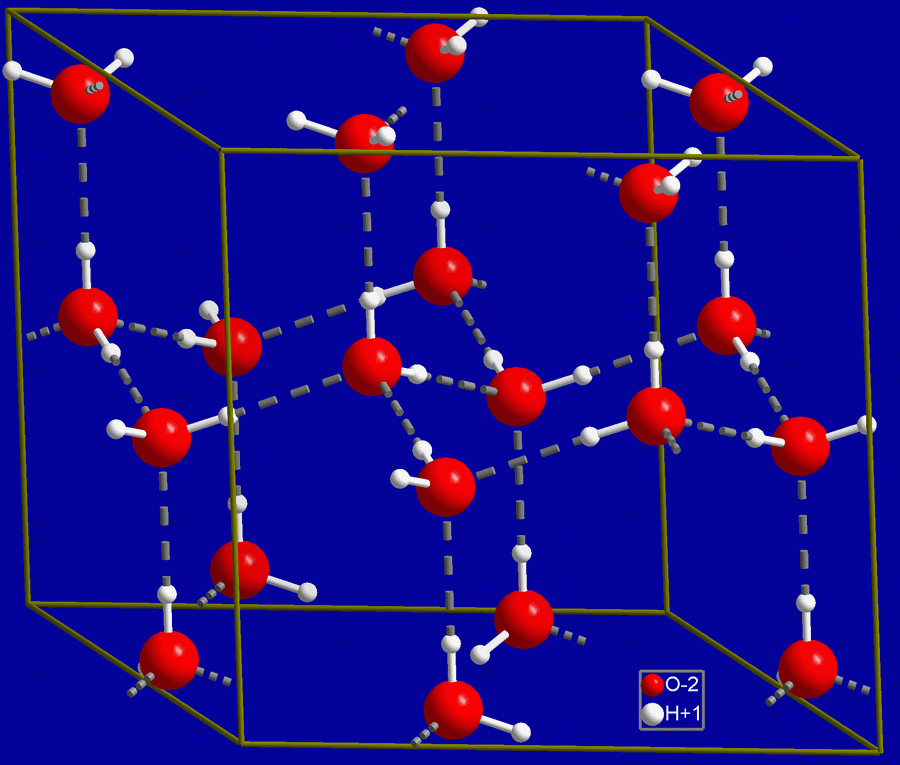
Кристаллическая структура льда
Кристаллическая структура льда похожа на структуру алмаза: каждая молекула Н20 окружена четырьмя ближайшими к ней молекулами, находящимися на одинаковых расстояниях от нее, равных 2,76Α и размещенных в вершинах правильного тетраэдра. В связи с низким координационным числом структура льда является ажурной, что влияет на его плотность (0,917). Лед имеет гексагональную пространственную решётку и образуется путём замерзания воды при 0°С и атмосферном давлении. Решётка всех кристаллических модификаций льда имеет тетраэдрическое строение. Параметры элементарной ячейки льда (при t 0°С): а=0,45446 нм, с=0,73670 нм (с — удвоенное расстояние между смежными основными плоскостями). При понижении температуры они меняются крайне незначительно. Молекулы Н20 в решётке льда связаны между собой водородными связями. Подвижность атомов водорода в решётке льда значительно выше подвижности атомов кислорода, благодаря чему молекулы меняют своих соседей. При наличии значительных колебательных и вращательных движений молекул в решётке льда возникают трансляционные соскоки молекул из узла пространственной их связи с нарушением дальнейшей упорядоченности и образованием дислокаций. Этим объясняется проявление у льда специфических реологических свойств, характеризующих зависимость между необратимыми деформациями (течением) льда и вызвавшими их напряжениями (пластичность, вязкость, предел текучести, ползучесть и др.). В силу этих обстоятельств ледники текут аналогично сильно вязким жидкостям, и, таким образом, природные льды активно участвуют в круговороте воды на Земле. Кристаллы льда имеют относительно крупные размеры (поперечный размер от долей миллиметра до нескольких десятков сантиметров). Они характеризуются анизотропией коэффициента вязкости, величина которого может меняться на несколько порядков. Кристаллы способны к переориентации под действием нагрузок, что влияет на их метаморфизацию и скорости течения ледников.
СВОЙСТВА
Лёд бесцветен. В больших скоплениях он приобретает синеватый оттенок. Блеск стеклянный. Прозрачный. Спайности не имеет. Твердость 1,5. Хрупкий. Оптически положительный, показатель преломления очень низкий (n = 1,310, nm = 1,309). В природе известны 14 модификаций льда. Правда, все, кроме привычного нам льда, кристаллизующего в гексагональной сингонии и обозначающегося как лёд I , образуются в условиях экзотических — при очень низких температурах (порядка -110150 0С) и высоких давлениях, когда углы водородных связей в молекуле воды изменяются и образуются системы, отличные от гексагональной. Такие условия напоминают космические и не встречаются на Земле. Например, при температуре ниже –110 °С водяные пары выпадают на металлической пластине в виде октаэдров и кубиков размером в несколько нанометров — это так называемый кубический лед. Если температура чуть выше –110 °С, а концентрация пара очень мала, на пластине формируется слой исключительно плотного аморфного льда.
МОРФОЛОГИЯ
Пласты арктического льда
В природе лёд — очень распространенный минерал. В земной коре существует несколько разновидностей льда: речной, озёрный, морской, грунтовый, фирновый и глетчерный. Чаще он образует агрегатные скопления мелкокристаллических зерен. Известны также кристаллические образования льда, возникающие сублимационным путем, т. е. непосредственно из парообразного состояния. В этих случаях лед имеет вид скелетных кристаллов (снежинки) и агрегатов скелетного и дендритного роста (пещерный лёд, изморозь, иней и узоры на стекле). Крупные хорошо огранённые кристаллы встречаются, но очень редко. Н. Н. Стуловым описаны кристаллы льда северо-восточной части России, встреченные на глубине 55—60 м. от поверхности, имеющие изометрический и столбчатый облик, причем длина наибольшего кристалла равнялась 60 см., а диаметр его основания — 15 см. Из простых форм на кристаллах льда выявлены только грани гексагональной призмы (1120), гексагональной бипирамиды (1121) и пинакоида (0001).
Ледяные сталактиты, называемые в просторечии «сосульки», знакомы каждому. При перепадах температур около 0° в осенне-зимние сезоны они растут повсеместно на поверхности Земли при медленном замерзании (кристаллизации) стекающей и капающей воды. Они обычны также в ледяных пещерах.
Ледяные забереги представляют собой полосы ледяного покрова из льда, кристаллизующегося на границе вода-воздух вдоль краёв водоёмов и окаймляющие края луж, берега рек, озёр, прудов, водохранилищ, и тп. при незамерзающей остальной части водного пространства. При их полном срастании на поверхности водоёма образуется сплошной ледяной покров.
Лёд образует также параллельно-шестоватые агрегаты в виде волокнистых прожилков в пористых грунтах, а на их поверхности — ледяные антолиты.
ПРОИСХОЖДЕНИЕ
Лёд образуется в основном в водных бассейнах при понижении температуры воздуха. На поверхности воды при этом появляется ледяная каша, сложенная из иголочек льда. Снизу на неё нарастают длинные кристаллики льда, у которых оси симметрии шестого порядка размещаются перпендикулярно к поверхности корочки. Соотношения между кристаллами льда при разных условиях образования показаны на рис. Лед распространен всюду, где имеется влага и где температура опускается ниже 0° С. В некоторых районах грунтовый лед оттаивает только на незначительную глубину, ниже которой начинается вечная мерзлота. Это так называемые районы вечной мерзлоты; в областях распространения многолетнемерзлых пород в верхних слоях земной коры встречаются так называемые подземные льды, среди которых различают современный и ископаемый подземный лёд. Не менее 10% всей площади суши Земли покрывают ледники, слагающая их монолитная ледяная порода носит название ледниковый лёд. Ледниковый лёд образуется в основном из скопления снега в результате его уплотнения и преобразования. Ледниковый покров занимает около 75% площади Гренландии и почти всю Антарктиду; самая большая мощность ледников (4330 м.) – установлена близ станции Бэрд (Антарктида). В центральной Гренландии толщина льда достигает 3200 м.
Месторождения льда общеизвестны. В местностях с холодной долгой зимой и коротким летом, а также в высокогорных районах образуются ледяные пещеры со сталактитами и сталагмитами, среди которых наиболее интересными являются Кунгурская в Пермской области Приуралья, а также пещера Добшине в Словакии.
В результате замерзания морской воды образуется морской лёд. Характерными свойствами морского льда являются солёность и пористость, которые определяют диапазон его плотности от 0,85 до 0,94 г/см 3 . Из-за такой малой плотности льдины возвышаются над поверхностью воды на 1/7-1/10 своей толщины. Морской лёд начинает таять при температуре выше -2,3° С; он более эластичен и труднее поддается раздроблению на части, чем лёд пресноводный.
ПРИМЕНЕНИЕ
В конце 1980-х годов лаборатория Аргонн разработала технологию изготовления ледяной гидросмеси (Ice Slurry), способной свободно течь по трубам различного диаметра, не собираясь в ледяные наросты, не слипаясь и не забивая системы охлаждения. Солёная водяная суспензия состояла из множества очень мелких ледяных кристалликов округлой формы. Благодаря этому сохраняется подвижность воды и, одновременно, с точки зрения теплотехники она представляет собой лёд, который в 5—7 раз эффективнее простой холодной воды в системах охлаждения зданий. Кроме того, такие смеси перспективны для медицины. Опыты на животных показали, что микрокристаллы смеси льда прекрасно проходят в довольно мелкие кровеносные сосуды и не повреждают клетки. «Ледяная кровь» удлиняет время, в течение которого можно спасти пострадавшего. Скажем, при остановке сердца это время удлиняется, по осторожным оценкам, с 10—15 до 30—45 минут.
Использование льда в качестве конструкционного материала широко распространено в приполярных регионах для строительства жилищ — иглу. Лёд входит в состав предложенного Д. Пайком материала Пайкерит, из которого предлагалось сделать самый большой в мире авианосец.
Источник
Ледяные кристаллы
Ледяные кристаллы
| Лёд | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Вода |
| Химическая формула | Н2O |
| Молярная масса | 18,01528 г/моль |
| Физические свойства | |
| Плотность вещества | 0,917 г/см³ |
| Состояние (ст. усл.) | жидкость |
| Термические свойства | |
| Тройная точка | 0,01 °C, 611,73 Па |
| Удельная теплота плавления | 3,3 · 10 5 Дж/кг |
В широком смысле, лёд — это твёрдое состояние такого неметаллического вещества, которое при стандартной температуре и давлении находится в жидком или газообразном состоянии. Например, сухой лёд, аммиачный лёд или метановый лёд.
Содержание
Основные свойства водного льда
Лёд может существовать в трёх аморфных разновидностях и 15 кристаллических модификациях. Фазовая диаграмма на рисунке справа показывает при каких температурах и давлениях существуют некоторые из этих модификаций (более полное описание см.ниже).
В природных условиях Земли лёд представлен, главным образом, одной кристаллической модификацией, кристаллизующейся в гексагональной сингонии (лёд Ih). Во льду Ih каждая молекула Н2O окружена четырьмя ближайшими к ней молекулами, находящимися на одинаковых расстояниях от неё, равных 2,76 Å и размещенных в вершинах правильного тетраэдра.
Ажурная структура такого льда приводит к тому, что его плотность, равная 916,7 кг/м³ при 0°C, ниже плотности воды (999,8 кг/м³) при той же температуре. Поэтому вода, превращаясь в лёд, увеличивает свой объём примерно на 9 %. Кроме того, лёд, будучи легче жидкой воды, образуется на поверхности водоёмов, что препятствует дальнейшему замерзанию воды.
Высокая удельная теплота плавления льда, равная 330 кДж/кг, (для сравнения — удельная теплоты плавления железа равна 270 кДж/кг), служит важным фактором в обороте тепла на Земле. Так, чтобы растопить 1 кг льда или снега, нужно столько же тепла, чтобы нагреть литр воды до 80°C
Лёд встречается в природе в виде собственно льда (материкового, плавающего, подземного), а также в виде снега, инея и т. д. Под действием собственного веса лёд приобретает пластические свойства и текучесть.
Природный лёд обычно значительно чище, чем вода, так как при кристаллизации воды в первую очередь в решётку встают молекулы воды (см. зонная плавка). Лёд может содержать механические примеси — твёрдые частицы, капельки концентрированных растворов, пузырьки газа. Наличием кристалликов соли и капелек рассола объясняется солоноватость морского льда.
Искусственный лёд получается охлаждением, происходящим при растворении некоторых солей в воде или кислотах или охлаждением при испарении жидкостей в разрежённом пространстве.
Лёд на Земле
Общие запасы льда на Земле около 30 млн км³. Основные запасы льда на Земле сосредоточены в полярных шапках (главным образом, в Антарктиде, где толщина слоя льда достигает 4 км).
В океане
Вода в мировом океане солёная и это препятствует образованию льда, поэтому лёд образуется только в полярных и субполярных широтах, где зима долгая и очень холодная. Замерзают некоторые неглубокие моря, расположенные в умеренном поясе. Различают однолетние и многолетние льды. Морской лёд может быть неподвижным, если связан с сушей, или плавучим, то есть дрейфующим. В океане встречаются льды, отколовшиеся от ледников суши и спустившиеся в океан в результате абляции, — айсберги.
Лёд в космосе
Имеются данные о наличии льда на планетах Солнечной системы и в ядрах комет. Изо льда сложена поверхность Европы — спутника Юпитера.
Использование льда в технике
Ледяная гидросмесь. В конце 1980-х годов лаборатория Аргонн разработала технологию изготовления ледяной гидросмеси (Ice Slurry), способной свободно течь по трубам различного диаметра, не собираясь в ледяные наросты, не слипаясь и не забивая системы охлаждения [1] . Солёная водяная суспензия состояла из множества очень мелких ледяных кристалликов округой формы. Благодаря этому сохраняется подвижность воды и, одновременно, с точки зрения теплотехники она представляет собой лёд, который в 5—7 раз эффективнее простой холодной воды в системах охлаждения зданий. Кроме того, такие смеси перспективны для медицины. Опыты на животных показали, что микрокристаллы смеси льда прекрасно проходят в довольно мелкие кровеносные сосуды и не повреждают клетки. «Ледяная кровь» удлиняет время, в течение которого можно спасти пострадавшего. Скажем, при остановке сердца это время удлиняется, по осторожным оценкам, с 10—15 до 30—45 минут.
Фазы льда
| Фаза | Характеристики [2] [3] |
|---|---|
| Аморфный лёд | Аморфный лёд не обладает кристаллической структурой. Он существует в трех формах: аморфный лёд низкой плотности (LDA), образующийся при атмосферном давлении и ниже, аморфный лёд высокой плотности (HDA) и аморфный лёд очень высокой плотности (VHDA), образующийся при высоких давлениях. Лёд LDA получают очень быстрым охлаждением жидкой воды («сверхохлажденная стекловидная вода», HGW), или конденсацией водяного пара на очень холодной подложке («аморфная твёрдая вода», ASW), или путем нагрева высокоплотностных форм льда при нормальном давлении («LDA»). |
| Лёд Ih | Обычный гексагональный кристаллический лёд. Практически весь лёд на Земле относится ко льду Ih, и только очень малая часть — ко льду Ic. |
| Лёд Ic | Метастабильный кубический кристаллический лёд. Атомы кислорода расположены как в кристаллической решётке алмаза. Его получают при температуре в диапазоне 130—150 K, он остается устойчивым до 200 K, а при дальнейшем нагреве переходит в лёд Ih. Он изредка встречается в верхних слоях атмосферы. |
| Лёд II | Тригональный кристаллический лёд с высокоупорядоченной структурой. Образуется изо льда Ih при сжатии и температурах 190—210 K. При нагреве он преобразуется в лёд III. |
| Лёд III | Тетрагональный кристаллический лёд, который возникает при охлаждении воды до 250 K и давлении 300 МПа. Его плотность больше, чем у воды, но он наименее плотный из всех разновидностей льда в зоне высоких давлений. |
| Лёд IV | Метастабильный тригональный лёд. Его трудно получить без нуклеирующей затравки. |
| Лёд V | Моноклинный кристаллический лёд. Возникает при охлажении воды до 253 K и давлении 500 МПа. Обладает самой сложной структурой по сравнению со всеми другими модификациями. |
| Лёд VI | Тетрагональный кристаллический лёд. Образуется при охлажении воды до 270 K и давлении 1,1 ГПа. В нём проявляется дебаевская релаксация. |
| Лёд VII | Кубическая модификация. Нарушено расположение атомов водорода; в веществе проявляется дебаевская релаксация. Водородные связи образуют две взаимопроникающие решётки. |
| Лёд VIII | Более упорядоченный вариант льда VII, где атомы водорода занимают, очевидно, фиксированные положения. Образуется изо льда VII при его охлаждении ниже 5 °C. |
| Лёд IX | Тетрагональная метастабильная модификация. Постепенно образуется изо льда III при его охлаждении от 208 K до 165 K, стабилен при температуре ниже 140 K и давлениях между 200 и 400 МПа. Его плотность 1,16 г/см³, то есть, несколько выше, чем у обычного льда. |
| Лёд X | Симметричный лёд с упорядоченным расположением протонов. Образуется при давлениях около 70 ГПа. |
| Лёд XI | Ромбическая низкотемпературная равновесная форма гексагонального льда. Является сегнетоэлектриком. |
| Лёд XII | Тетрагональная метастабильная плотная кристаллическая модификация. Наблюдается в фазовом пространстве льда V и льда VI. Можно получить нагреванием аморфного льда высокой плотности от 77 K до примерно 183 K и при давлении 810 МПа. |
| Лёд XIII | Моноклинная кристаллическая разновидность. Получается при охлаждении воды ниже 130 K и давлении 500 МПа. Разновидность льда V с упорядоченным расположением протонов. |
| Лёд XIV | Ромбическая кристаллическая разновидность. Получается при температуре ниже 118 K и давлении 1,2 ГПа. Разновидность льда XII с упорядоченным расположением протонов. |
| Лёд XV | Предсказанная (но ещё не подтвержденная) разновидность льда VI с упорядоченным расположением протонов. Предполагается, что можно получить путем охлажения воды примерно до 108—80 K и давлении 1,1 ГПа. |
Новые исследования формирования водяного льда на ровной поверхности меди при температурах 100—140 K показали, что сначала на поверхности возникают цепочки молекул шириной около 1 нм не гексагональной, а пентагональной структуры [4] .
Источник