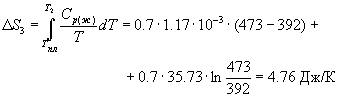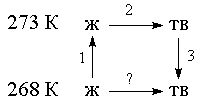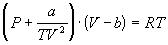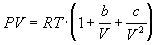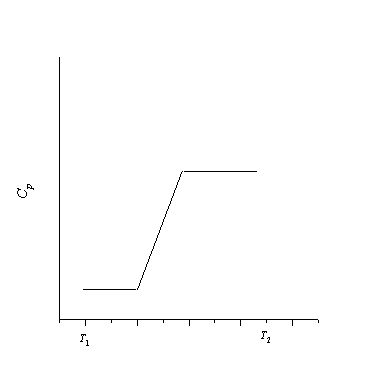Найти изменение энтропии при плавлении массы льда 1 кг при температуре 00 с
Второй закон термодинамики устанавливает критерии необратимости термодинамических процессов. Известно много формулировок второго закона, которые эквивалентны друг другу. Мы приведем здесь только одну формулировку, связанную с энтропией.
Существует функция состояния — энтропия S, которая обладает следующим свойством:
, (4.1) где знак равенства относится к обратимым процессам, а знак больше — к необратимым.
Для изолированных систем второй закон утверждает: dS і 0, (4.2) т.е. энтропия изолированных систем в необратимых процессах может только возрастать, а в состоянии термодинамического равновесия она достигает максимума (dS = 0,
d 2 S -23 Дж/К — постоянная Больцмана (k = R / NA), W — так называемая термодинамическая вероятность, т.е. число микросостояний, которые соответствуют данному макросостоянию системы (см. гл. 10). Формулу (4.4) называют формулой Больцмана.
С точки зрения строгой статистической термодинамики энтропию вводят следующим образом:
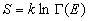
где G (E) — фазовый объем, занятый микроканоническим ансамблем с энергией E.
Термодинамическое определение энтропии основано на рассмотрении обратимых процессов:
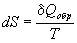
Это определение позволяет представить элементарную теплоту в такой же форме, как и различные виды работы:
Qобр = TdS, (4.7)
где температура играет роль обобщенной силы, а энтропия — обобщенной (тепловой) координаты.
Расчет изменения энтропии для различных процессов
Термодинамические расчеты изменения энтропии основаны на определении (4.6) и на свойствах частных производных энтропии по термодинамическим параметрам:
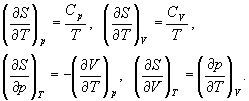
Последние два тождества представляют собой соотношения Максвелла (вывод см. в гл. 5).
1) Нагревание или охлаждение при постоянном давлении.
Количество теплоты, необходимое для изменения температуры системы, выражают с помощью теплоемкости: Qобр = Cp dT.
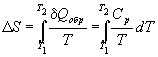
Если теплоемкость не зависит от температуры в интервале от T1 до T2, то уравнение (4.8) можно проинтегрировать:
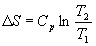
Если изменение температуры происходит при постоянном объеме, то в формулах (4.9) и (4.10) Cp надо заменить на CV.
2) Изотермическое расширение или сжатие.
Для расчета энтропии в этом случае надо знать уравнение состояния системы. Расчет основан на использовании соотношения Максвелла:
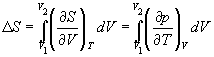
В частности, для изотермического расширения идеального газа (p = nRT / V)
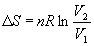
Этот же результат можно получить, если использовать выражение для теплоты изотермического обратимого расширения идеального газа: Qобр = nRT ln(V2/V1).
3) Фазовые переходы.
При обратимом фазовом переходе температура остается постоянной, а теплота фазового перехода при постоянном давлении равна Hфп, поэтому изменение энтропии равно:
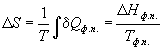
При плавлении и кипении теплота поглощается, поэтому энтропия в этих процессах возрастает: Sтв о С при давлении 1 атм. Мольная теплоемкость серы равна:
Температура плавления моноклинной серы 119 о С, удельная теплота плавления 45.2 Дж/г.
Решение. Общее изменение энтропии складывается из трех составляющих: 1) нагревание твердой серы от 25 до 119 о С, 2) плавление, 3) нагревание жидкой серы от 119 до 200 о С.
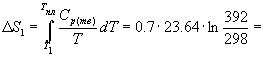
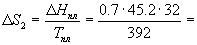
S = S1 + S2 + S3 = 11.88 Дж/К.
Пример 4-3. Найдите изменение энтропии газа и окружающей среды, если n молей идеального газа расширяются изотермически от объема V1 до объема V2: а) обратимо; б) против внешнего давления p.
Решение. а) Изменение энтропии газа при обратимом изотермическом расширении можно найти с помощью термодинамического определения энтропии с расчетом теплоты расширения по первому закону:
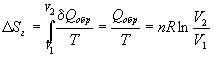
Так как расширение обратимое, то общее изменение энтропии Вселенной равно 0, поэтому изменение энтропии окружающей среды равно изменению энтропии газа с обратным знаком:
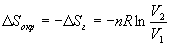
б) Энтропия — функция состояния, поэтому изменение энтропии системы не зависит от того, как совершался процесс — обратимо или необратимо. Изменение энтропии газа при необратимом расширении против внешнего давления будет таким же, как и при обратимом расширении. Другое дело — энтропия окружающей среды, которую можно найти, рассчитав с помощью первого закона теплоту, переданную системе:
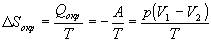
В этом выводе мы использовали тот факт, что U = 0 (температура постоянна). Работа, совершаемая системой против постоянного внешнего давления равна: A = p(V2—V1), а теплота, принятая окружающей средой, равна работе, совершенной системой, с обратным знаком.
Общее изменение энтропии газа и окружающей среды больше 0:
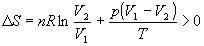
как и полагается для необратимого процесса.
Пример 4-4. Рассчитайте изменение энтропии 1000 г воды в результате ее замерзания при -5 О С. Теплота плавления льда при 0 о С равна 6008 Дж/моль. Теплоемкости льда и воды равны 34.7 и 75.3 Дж/(моль . К), соответственно. Объясните, почему энтропия при замерзании уменьшается, хотя процесс — самопроизвольный.
Решение. Необратимый процесс замерзания воды при температуре -5 О С можно представить в виде последовательности обратимых процессов: 1) нагревание воды от
-5 О С до температуры замерзания (0 О С); 2) замерзание воды при 0 О С; 3) охлаждение льда от 0 до -5 О С:
Изменение энтропии в первом и третьем процессах (при изменении температуры) рассчитывается по формуле (4.9):
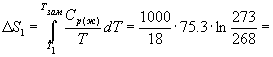
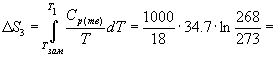
Изменение энтропии во втором процессе рассчитывается как для обычного фазового перехода (4.13). Необходимо только иметь в виду, что теплота при замерзании выделяется:
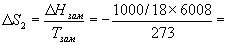
Т.к. энтропия — функция состояния, общее изменение энтропии равно сумме по этим трем процессам:
S = S1 + S2 + S3 = -1181 Дж/К.
Энтропия при замерзании убывает, хотя процесс самопроизвольный. Это связано с тем, что в окружающую среду выделяется теплота и энтропия окружающей среды увеличивается, причем это увеличение больше, чем 1181 Дж/К, поэтому энтропия Вселенной при замерзании воды возрастает, как и полагается в необратимом процессе.
ЗАДАЧИ
4-1. Приведите пример термодинамического процесса, который может быть проведен как обратимо, так и необратимо. Рассчитайте изменение энтропии системы и окружающей среды в обоих случаях.
4-2. Проверьте неравенство Клаузиуса для циклического процесса, представленного в задаче 2.14.
4-3. Рассчитайте мольную энтропию неона при 500 К, если при 298 К и том же объеме энтропия неона равна 146.2 Дж/(моль . К).
4-4. Рассчитайте изменение энтропии при нагревании 11.2 л азота от 0 до 50 о С и одновременном уменьшении давления от 1 атм до 0.01 атм.
4-5. Один моль гелия при 100 о С и 1 атм смешивают с 0.5 моль неона при 0 о С и 1 атм. Определите изменение энтропии, если конечное давление равно 1 атм.
4-6. Рассчитайте изменение энтропии при образовании 1 м 3 воздуха из азота и кислорода (20 об.%) при температуре 25 о С и давлении 1 атм.
4-7. Три моля идеального одноатомного газа (CV = 3.0 кал/(моль . К)), находящегося при T1 = 350 K и P1 = 5.0 атм, обратимо и адиабатически расширяются до давления P2 = 1.0 атм. Рассчитайте конечные температуру и объем, а также совершенную работу и изменение внутренней энергии, энтальпии и энтропии в этом процессе.
4-8. Рассчитайте изменение энтропии при нагревании 0.4 моль хлорида натрия от 20 до 850 о С. Мольная теплоемкость хлорида натрия равна:
Температура плавления хлорида натрия 800 о С, теплота плавления 31.0 кДж/моль.
4-9. Рассчитайте изменение энтропии при смешении 5 кг воды при 80 о С с 10 кг воды при 20 о С. Удельную теплоемкость воды принять равной: Cp(H2O) = 4.184 Дж/(г . К).
4-10. Рассчитайте изменение энтропии при добавлении 200 г льда, находящегося при температуре 0 о С, к 200 г воды (90 о С) в изолированном сосуде. Теплота плавления льда равна 6.0 кДж/моль.
4-11. Для некоторого твердого тела найдена зависимость коэффициента расширения от давления в интервале давлений от p1 до p2:
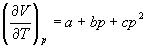
Насколько уменьшится энтропия этого тела при сжатии от p1 до p2?
4-12. Найдите изменение энтропии газа и окружающей среды, если n молей идеального газа расширяются изотермически от давления p1 до давления p2: а) обратимо; б) против внешнего давления p 0 С и давлении 2 атм.
4-14. Нарисуйте график зависимости стандартной энтропии воды от температуры в интервале от 0 до 400 К.
4-15. Запишите энтропию одного моля идеального газа как функцию температуры и давления (теплоемкость считать постоянной).
4-16. Определите зависимость энтропии от объема для термодинамической системы, которая описывается уравнением состояния (для одного моля):
4-17. Определите зависимость энтропии от объема для термодинамической системы, которая описывается уравнением состояния (для одного моля):
4-18. Один моль газа описывается уравнением состояния
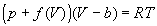
где f(V) — некоторая функция, которая не зависит от температуры. Рассчитайте изменение энтропии газа при его необратимом изотермическом расширении от объема V1 до объема V2.
4-19. Рассчитайте изменение энтропии 1000 г метанола в результате его замерзания при -105 О С. Теплота плавления твердого метанола при -98 о С (т.пл.) равна 3160 Дж/моль. Теплоемкости твердого и жидкого метанола равны 55.6 и 81.6 Дж/(моль . К), соответственно. Объясните, почему энтропия при замерзании уменьшается, хотя процесс — самопроизвольный.
4-20. Теплоемкость некоторого вещества в интервале температур от T1 до T2 изменяется следующим образом:
Постройте график зависимости энтропии вещества от температуры в этом интервале температур.
4-21. Пользуясь справочными данными, приведите пример самопроизвольной химической реакции, для которой стандартное изменение энтропии меньше 0.
4-22. Пользуясь справочными данными, рассчитайте стандартное изменение энтропии в реакции H2(г) + ЅO2(г) = H2O(г) а) при 25 о С; б) при 300 о С.


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Источник
Лабораторная работа по физике. Практические занятия
Изменение энтропии определяется по формуле:
Общее изменение энтропии равно сумме , где – изменения энтропии, происходящие на отдельных этапах процесса:
1. Изменение энтропии происходит при нагревании льда от начальной температуры T1 = 263 K до температуры плавления T2= 273 K: , так как , то , где m – масса льда; с1 – удельная теплоемкость льда.
2. Изменение энтропии происходит при плавлении льда. В этом случае . Тогда: , где T2 – температура плавления льда; λ – удельная теплота плавления.
3. Изменение энтропии происходит при нагревании воды от температуры T2 до температуры кипения T3 = 373 K. Величина вычисляется аналогично :
где с2 – удельная теплоемкость воды.
4. Изменение энтропии происходит при испарении воды; так как , то
где r – удельная теплота парообразования.
Общее изменение энтропии
Ответ: 1,73·104 Дж/К.
Задача 20 . Резиновый шнур, жесткость которого k = 3 · H/м под действием груза удлинился на см. Считая процесс растяжения шнура изотермическим и происходящим при температуре t = 27°C, определить изменение энтропии.
k = 3·10 Согласно 1-го закона термодинамики
t = 27°C Так как при изотермическом процессе
Процесс растяжения шнура происходит при постоянной температуре, а значит изменения внутренней энергии не происходит. Работа А равна изменению потенциальной энергии резинового шнура:
Задача 21. Углекислый газ массой 88 г находится в сосуде емкостью 10 л. Определить внутреннее давление газа и собственный объем молекул.
V = 10 л = 10 –2 м3
m = 88 г = 8,8·10-2 кг
М = 4,4·10-2 кг/моль
а = 0,361 Н·м/моль2
b = 4,28·10-5 м3/моль
По уравнению Ван-дер-Ваальса выражение добавочного давления р/ имеет вид:
где а–постоянная Ван-дер-Ваальса, V – объем.
Постоянная Ван-дер-Ваальса b учитывает поправку на собственный объем молекул V’, и, как следует из уравнения Ван-дер-Ваальса, произведение равно учетверенному объему молекул , откуда:
Савельев И.В. Курс общей физики. Кн.1. – М.: Наука, 1999.
Трофимова Т.И. Курс физики. – М.: Высшая школа, 2003.
Детлаф А.А., Яворский Б.М. Курс физики. – М.: Высшая школа, 2002.
Волькенштейн В.С. Сборник задач по общему курсу физики. – СПб.: СпецЛит, 2001.
Чертов А.Г., Воробьев А.А. Задачник по физике. – М.: Интеграл–пресс, 1997.
После замены теплоизолирующей перегородки теплопроводящей и выравнивания температур до средней температуры q = (Т1+Т2)/2, новое значение энтропии, вычисленное через эффективные объемы, будет
так как после выравнивания температур разброс импульсов у молекул теперь одинаков.
___По свойству дисперсии гауссова распределения легко видеть, что D pi = Ö mkT и, следовательно, S(1)=Const S D pi( Ö T1+ Ö T2) и S(2) =Const S D pi [ Ö 2(T1+T2)]. Отсюда легко находится отношение начального значения энтропии к её конечному _ _ ______
S(1)/ S(2) = ( Ö T1+ Ö T2)/ Ö 2(T1+T2)
Для утверждения, что эффективный объем возрастает после выравнивания температур, осталось показать, что правая часть равенства меньше единицы. Для этого возводим правую часть в квадрат, делим числитель на знаменатель и получаем выражение
где в числителе дроби оказалось среднее геометрическое, а в знаменателе — среднее арифметическое первоначальных температур, но первое, как известно, всегда меньше второго. Следовательно, правая часть уравнения для отношения энтропий меньше единицы, и значит S(1) S(2). Тем самым показано, что эффективный объем ведет себя при необратимых процессах выравнивания температур так же, как и энтропия, то есть возрастает, как и должно быть, если этот объём является наглядным отображением энтропии в фазовом пространстве.
Как видно из всех рассмотренных примеров, эффективный объем ведет себя как в обратимых, так и в необратимых процессах так, что вычисленный через него статистический вес и, соответственно, энтропия ведут себя согласно предсказаниям термодинамики. Чем больше эффективный объем у каждой частицы, тем больше статистический вес термодинамической системы в целом, и тем больше (через логарифм) энтропия. Сообщая термодинамической системе теплоту, мы тем самым увеличиваем степень хаотичности ее состояния, «раздуваем» эффективный объем каждой частицы, увеличиваем статистический вес системы и наращиваем энтропию. Из вышеизложенного следует, что статистическому весу, и тем самым энтропии, может быть сопоставлен наглядный образ – эффективный объем в фазовом пространстве.
Источник
 , (4.1) где знак равенства относится к обратимым процессам, а знак больше — к необратимым.
, (4.1) где знак равенства относится к обратимым процессам, а знак больше — к необратимым.