Сахар против льда сообщение
Подробное решение параграф § 7 по биологии для учащихся 10 класса, авторов Пасечник В.В., Каменский А.А., Рубцов A.M. Углубленный уровень 2019
Вопрос 1. Какие вещества называют неорганическими?
Неорганические вещества — простые вещества и соединения, не являющиеся органическими, т. е. не содержащие углерода, а также некоторые углеродосодержащие соединения (карбиды, цианиды, карбонаты, оксиды углерода и некоторые другие вещества, которые традиционно относят к неорганическим).
Вопрос 2. Какие известные вам организмы содержат много воды?
Алоэ, кактусы, водоросли, медуза, в плодах огурцов и др.
Вопрос 3. Какие неорганические вещества мы употребляем в пищу? Почему?
Воду, минеральные вещества (кальций, магний, йод, фосфор, медь и др.). Они способствуют проникновению веществ в клетки организма, протекание ферментативных и пластических процессов, участвуют в формировании и построении тканей, поддерживают осмотическое давление крови, активируют проведение возбуждения и импульсов, способствуют свертыванию крови и т. д.
Вопрос 4. Какие неорганические вещества содержатся в живых организмах?
Вода, соли минеральных кислот и соответствующие катионы и анионы.
Вопрос 5. Что определяет уникальные физические и химические свойства воды, столь важные для существования живой материи?
Уникальные физические и химические свойства воды определяются особенностями структуры её молекулы, которые возникают в результате специфического расположения электронов в атомах кислорода и водорода.
Вопрос 6. Какие химические связи называют водородными?
Водородные связи — это такие связи, которые возникают между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой молекулы.
Вопрос 7. Какие физико — химические свойства воды наиболее важны для обеспечения жизнедеятельности клеток и многоклеточных организмов в разных условиях?
Высокая теплоёмкость (способность поглощать тепло при незначительном изменении собственной температуры) воды предохраняет клетку от резких температурных колебаний, а высокая теплопроводность обеспечивает возможность равномерного распределения теплоты между отдельными частями организма. Высокая теплота испарения используется живыми организмами для предохранения от перегрева: испарение жидкости растениями и животными охлаждает организм и является защитной реакцией на повышение температуры. Вода практически несжимаема, благодаря чему клетки поддерживают свою форму и обладают упругостью. Очень важно, что лёд легче воды, так как вода имеет максимальную плотность при +4°С, поэтому пресные водоёмы не промерзают до дна.
Для живых организмов весьма важно ещё и то, что молекулы воды являются диполями. Дипольный характер молекулы воды определяет её способность ориентироваться в электрическом поле. Именно это свойство воды определяет её уникальность как растворителя.
Вопрос 8. В каких растворителях могут растворяться гидрофобные вещества, а в каких — гидрофильные? Какие растворители вам известны?
Гидрофильные вещества легко разрушается в воде, гидрофобные — в бензине или в бензоле.
Вопрос 9. Используя интернет — ресурсы и другие источники информации, найдите сведения о значении для организма следующих элементов: В, Р, S, Са, Мn, Fe, Со, Zn, Сu. Ответ оформите в виде таблицы.
Вопрос 10. Прочитайте статью «Сахар против льда» и на основе анализа полученной информации предложите свои способы борьбы с гололёдом на дорогах.
При повышении безопасности дорожного движения в снежное время года, мы не должны забывать об экологической обстановке.
Сахар — это интересно, экологично, но скорее всего дорого.
Учитывая все недостатки при использовании соли и солевых растворов, связанных с их негативным воздействием на окружающую среду, наиболее целесообразным является способ предупреждения образования гололеда за счет создания покрытий автомобильных дорог, обладающих противо — гололедными свойствами, что делает возможным механическое удаление снежно — ледяных отложений снегоуборочной техникой и исключения отрицательного воздействия химических реагентов на окружающую среду.
1. К одному из способов образования антигололедных покрытий, разработанному в Словакии, относится «Соленый бетон». Антигололедная добавка с рабочим названием «Соленый бетон» представляет собой обработанные кристаллы против гололедного вещества (NaCl), введенные в минеральную часть асфальтобетона. Минеральная оболочка соли (NaCl) формируется из цемента, мелкозернистого известнякового порошка и дробленого песка. Введение добавки в количестве около 10 % по массе минерального материала является достаточным для достижения желаемого эффекта. При температуре около — 4°С небольшое количество соли (приблизительно 1 %) расплавляет тонкие слои снега. При температуре более низкой (ниже — 4°С) плотность льда нарушается; лед ломается и удаляется с поверхности дороги под действием колес транспортных средств. Если температура особенно низкая ( — 10°С), эффект «Соленого бетона» снижается, но сохраняется возможность достаточно простой очистки поверхности дороги с использованием дорожной щетки и отвала.
2. В Уральском государственном лесотехническом университете (УГЛТУ) для повышения противогололедных свойств асфальтобетона разработан кремнийорганический модификатор МПА — 130, не содержащий хлоридов. Устройство верхнего антигололедного слоя дорожного покрытия на основе гидрофобизирующего модификатора, не содержащего хлоридов, на автомобильных дорогах позволит вести активную борьбу с гололедом, благодаря чему повысится коэффициент сцепления колес автомобилей с дорожным покрытием и будет обеспечена нормальная работа транспорта. Кроме того, применение таких покрытий позволит улучшить экологическую обстановку придорожной полосы за счет отказа от применения хлоридов.
Вопрос 11. Уникальные свойства воды определяются в том числе существованием между её молекулами водородных связей. Возможно ли существование таких связей между молекулами других веществ?
Механизм возникновения водородной связи — частично электростатический и частично донорно — акцепторный.
Характерной чертой водородной связи является расстояние между атомом водорода и другим атомом, её образующим. Оно должно быть меньше, чем сумма радиусов этих атомов.
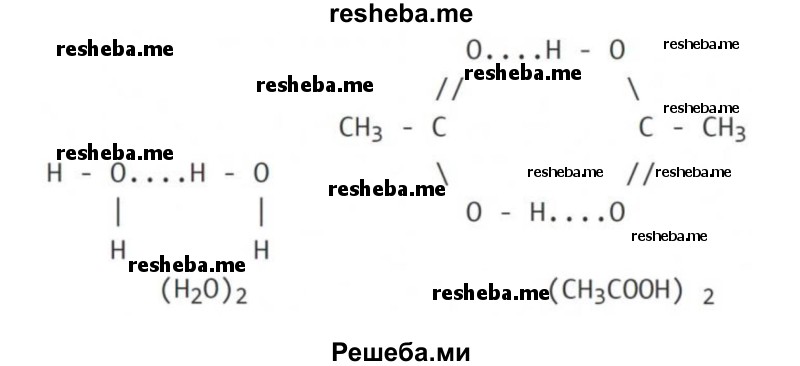
Межмолекулярная водородная связь образуется между молекулами веществ, в состав которых входят водород и сильно электроотрицательный элемент — фтор, кислород, азот, хлор, сера. Сильно смещенная общая электронная пара от водорода к атому отрицательно заряженного элемента, при этом положительный заряд водорода сконцентрирован в малом объеме, приводит взаимодействие протона с неподеленной электронной парой другого атома или иона, обобществляя её.
Водородную связь обозначают точками, указывая, что она намного слабее ковалентной связи (примерно в 15 — 20 раз).
Межмолекулярная водородная связь: две молекулы воды и две молекулы уксусной кислоты с образованием циклической структуры
Вопрос 12. Что произойдёт с клеткой, если концентрации ионов К+, Na+ и Са2+ выровняются и будут одинаковыми как вне, так и внутри её?
От концентрации солей внутри и снаружи клетки зависят буферные свойства цитоплазмы клетки. Буферностью называют способность клетки сохранять определенную концентрацию водородных ионов (рН). В клетке поддерживается слабощелочная реакция (рН 7,2). Пока клетка жива, эти различия в концентрации К+ и Na+ между клеткой и межклеточной средой стойко удерживаются. Если концентрации ионов К+, Na+ и Са2+ выровняются и будут одинаковыми как вне, так и внутри её, клетка просто умрет.
Вопрос 13. Используя доступные информационные источники, уточните, какие условия проведения эксперимента в естественных науках (давление, температура и др.) считаются нормальными. Обсудите с учителем и одноклассниками, почему при нормальных условиях вода (Н20) — это жидкость, а сероводород (H2S) — газ.
Нормальные условия — стандартные физические условия, с которыми обычно соотносят свойства веществ (при нормальных условиях, при н. у., англ. Standard temperature and pressure, STP). Нормальные условия определены IUPAC (Международным союзом чистой и прикладной химии) следующим образом:
Атмосферное давление 101325 Па = 760 мм рт. ст.
Температура воздуха 273,15 K = 0° C.
При нормальных условиях объём 1 моля идеального газа составляет 22,413 996(39) дм³ (молярный объём идеального газа), а количество молекул в 1 см³ составляет 2,686 7774(47)×1019 (постоянная Лошмидта).
Также в справочниках в качестве стандартных условий может указываться температура 298 K, либо +25 °С (298,15 К). Однако такая температура не установлена IUPAC в качестве стандартной, поэтому при использовании справочных данных всякий раз необходимо уточнять, при каких значениях приводятся величины.
Например, Национальный институт стандартов и технологий США (англ. National Institute of Standards and Technology, NIST) использует температуру +20 °C (293,15 K) и давление 101 325 Па (1 атм).
Вода (Н20) — это жидкость, а сероводород (H2S) — газ. Электроотрицательность кислорода выше, чем серы, электронная плотность в молекуле воды более смещена от водорода к кислороду, чем от водорода к сере, в молекуле сероводорода. Молекулы воды образуют между собой прочные водородные связи. В сероводороде водородные связи очень слабые. Поэтому вода при комнатной температуре жидкость, а сероводород — газ.
Или такой ответ, сформулированный иначе: кислород более электроотрицательный элемент, чем сера. Поэтому между молекулами воды возникают более прочные водородные связи, чем между молекулами сероводорода, разрыв этих связей, необходимый для перехода воды в газообразное состояние, требует значительной затраты энергии, что и приводит к аномальному повышению температуры кипения воды.
Источник
Как бороться со льдом на дорожках и почему нельзя использовать обычную соль в саду?
Зима в средней полосе России долго не сдает свои позиции. Одна из основных проблем, связанных с холодами и снегопадами — гололед. Мы рассмотрим основные способы борьбы с обледенением садовых дорожек
Раньше с гололедом боролись «дешево и сердито», посыпая дорожки солью. Но сегодня от этого варварского способа отказываются даже муниципальные службы. Соль — слишком едкий реагент, вредящий не только обуви пешеходов, но и тротуарному покрытию. А на даче применение соли может привести к еще более печальным последствиям. Весной она вместе с талой водой проникнет в почву, от чего неизбежно пострадают корни растущих вдоль дорожек растений.
Есть и еще одна веская причина отказаться от обычной соли: она эффективна только при относительно теплой погоде. На лютом морозе польза от нее почти неощутима.
Но в качестве посыпки можно использовать другие соли (хлориды), например, кальция или магния. Эти препараты продают в садоводческих магазинах как подкормку для растений. Используя их, дачник убивает двух зайцев — избавляется от наледи и превентивно удобряет почву.
На основе солей производят и специальные антискользящие средства для дорожек. Принцип их действия состоит в следующем: попадая на лед, кристаллы реагента начинают поглощать влагу и переходят из твердой фазы в жидкую. Процесс сопровождается активным выделением тепла, что и обеспечивает таянье ледяной корки.
При подборе антиобледенительных средств важно обращать внимание на их экологическую безопасность. Весной они неизбежно попадают в почву вместе с талой водой
К сожалению, у всех антискользящих химических средств есть одно ограничение. Они эффективны только при температурах, близких к нулю. Когда столбик термометра опускается ниже –22°С, приходится прибегать к другим мерам. Каким же? Прежде всего — к абразивным посыпкам. И самый распространенный вариант — песок. Лучше всего запастись им еще летом или осенью, набрав несколько ведер на берегу ближайшей реки. Купить песок в малых количествах более чем проблематично. Обычно его продают кубометрами, так что придется кооперироваться с соседями или нести убытки.
В Швейцарии есть еще один любопытный способ борьбы со льдом. Песок мелкой фракции смешивают с горячей водой в пропорции 7:3 и подают на дороги под давлением. Горячая смесь вплавляется в лед, и он становится шероховатым. Минус у данного метода лишь один — необходимость специального оборудования
В любом случае, посыпая дорожку песком, стоит помнить о том, что это временная мера. Ветер быстро сдувает его, а при оттепелях и последующих похолоданиях он вмерзает в лед и становится совершенно бесполезным. А значит, абразив придется наносить заново.
Если в доме есть печь или камин, можно также использовать золу. Но более эффективна каменная крошка фракции 2-6 мм. Чаще всего это гранит или мрамор. Он держится лучше, чем песок, и лучше разрушает наледь. Конечно, стоит такой абразив недешево, но его можно использовать многократно, и в странах Европы это обычная практика. С наступлением весны крошку сметают с дорог, промывают и хранят до той поры, пока она не понадобится снова.
Мраморная крошка обладает большей теплоемкостью, нежели гранитная, и потому она быстрее разрушает наледь
Если льда на дорожках слишком много, и при помощи посыпок проблему уже не решить, придется заняться ручной уборкой. При этом важно не повредить дорожное покрытие. А значит, нужно использовать не железные ломы и ледорубы, а деревянные лопаты и пластиковые совки.
К сожалению, работа «щадящими» инструментами затягивается на многие часы. Чтобы облегчить труд, лед можно немного растопить. Проще всего полить его горячей водой, но она скоро остынет и замерзнет. Лучше использовать смесь, приготовленную по нехитрому рецепту: 2 л. воды, 150-250 мл. водки и 100 мл. любого моющего средства. Этот раствор работает не хуже соли.
В завершении темы отметим, что существуют профилактические средства для борьбы с наледью. Речь идет о гидрофобизаторах — составах на кремнеорганической основе, которые выталкивает влагу из пор тротуарной плитки. Благодаря этому сцепление льда с поверхностью дорожного покрытия становится намного слабее, и его уборка не составляет особого труда.
Подписывайтесь на наш канал в Яндекс Дзен, чтобы ничего не пропустить!
Источник
В поисках секретного оружия против льда
5-02-2014, 21:12 | Экстремальные условия / Человек. Здоровье. Выживание | разместил: Редакция ОКО ПЛАНЕТЫ | комментариев: (0) | просмотров: (2 565)


В поисках секретного оружия против льда
Соль
Приблизительно 15 млн т соли для удаления льда используется каждый год в Соединённых Штатах. Исследование, проведённое Университетом Маркетта, показало, что соль на заснеженных трассах способна снизить количество аварий на 88% по сравнению с необработанными дорогами. Но хлорид натрия эффективен только при температуре выше -10 °C и может навредить водной флоре и фауне в результате попадания в грунтовые воды и реки, где он остаётся десятилетиями. Соль к тому же разъедает металлы, автомобили и бетон.
Сок сахарной свёклы
Вы, наверное, видели ролики, в которых демонстрируется, как свекольный сок растапливает лёд. На самом деле всё немножко не так, поясняет Стюарт Финдли из Института экосистемных исследований им. Кэри. Раствор свекольного сока играет роль «клея», к которому пристаёт соль, дабы минимизировать попадание соли в соседнюю реку. В этой роли могут выступать также патока, отходы пивоварения и прочие сахаристые вещества.
В довершение ко всему сахар снижает точку замерзания льда, поэтому соль получает возможность растопить лёд при температуре ниже -10 °C. Производители утверждают, что раствор на основе свекольного сока не оставляет пятен, несмотря на свой неприятный коричневый цвет. В то же время, к сожалению, попадая в воду, сахар привлекает микроорганизмы, которые поглощают весь окрестный кислород, из-за чего местная фауна задыхается.
Химия
В большинстве скобяных лавок вы найдёте нечто, рекламируемое как средство для удаления льда. Прежде чем покупать, взгляните на состав.
Хлорид кальция растопит снег при более низких температурах и быстрее, чем соль. А ещё он не так вреден для растений и животных. Но он разъедает металл и бетон и опасен для некоторых деревьев, а мокрый снег застывает и делает дорогу скользкой. Хлорид сам по себе, смешанный с водой, становится частью воды и не может быть оттуда извлечён, утверждают учёные. Следовательно, он будет вредить вечно.
Ацетат калия не содержит хлорида и должен применяться в качестве превентивной меры, чтобы лёд не приставал к тротуару. Этот раствор не позволяет льду формироваться при температуре до -60 °C. Он не вызывает образования ржавчины, разлагается микроорганизмами и расходуется медленнее, поскольку действует дольше. Но в связи с тем, что ацетат разлагается микроорганизмами, он приводит к снижению содержания кислорода в воде и тем вредит акважизни.
Огуречный рассол
Некоторые штаты, в частности Нью-Джерси, экспериментируют с огуречным рассолом. Да, он действует наподобие обыкновенного солевого раствора. Как и каменная соль, он растапливает лёд при температуре до -20 °C, к тому же предотвращает прилипание льда и снега к тротуару, так что дворникам меньше работы. Использование рассола снижает также попадание хлорида в окружающую среду на 15–30%.
Сырный рассол
Сырный рассол — это, чтоб вы знали, подсоленная вода, в которой плавают мягкие сыры (моцарелла и др.). Его применяют, например, в Висконсине. Местные чиновники и фермеры обнаружили, что такой рассол замерзает при лишь -30 °C. Недостаток у него только один — запах. Но пока никто не жаловался.
Сделай сам!
National Geographic рекомендует, не дожидаясь коммунальных служб, самостоятельно очистить дорожки от снега и льда с помощью солевых растворов с добавлением патоки или свекольного сока. Постарайтесь добиться максимального эффекта с минимальным использованием соли!
Подготовлено по материалам National Geographic.
Источник