- Температура плавления металлов. Самый тугоплавкий и легкоплавкий металл
- Температура плавления металлов
- Температура плавления разных металлов в таблице
- Как происходит
- Разделение металлов
- Температура плавления металлов. Самый тугоплавкий и легкоплавкий металл
- Глава IX. Жидкое «Серебро» и тяжелое «Серебришко» (Ртуть и платина)
Температура плавления металлов. Самый тугоплавкий и легкоплавкий металл
Почти все металлы при нормальных условиях представляют собой твердые вещества. Но при определенных температурах они могут изменять свое агрегатное состояние и становиться жидкими. Давайте узнаем, какая температура плавления металла самая высокая? Какая самая низкая?
Температура плавления металлов
Большая часть элементов периодической таблицы относится к металлам. В настоящее время их насчитывается примерно 96. Всем им необходимы разные условия, чтобы превратиться в жидкость.
Порог нагревания твердых кристаллических веществ, превысив который они становятся жидкими, называется температурой плавления. У металлов она колеблется в пределах нескольких тысяч градусов. Многие из них переходят в жидкость при относительно большом нагревании. Благодаря этому они являются распространенным материалом для производства кастрюль, сковородок и других кухонных приборов.
Средние температуры плавления имеют серебро (962 °С), алюминий (660,32 °С), золото (1064,18 °С), никель (1455 °С), платина (1772 °С) и т.д. Выделяют также группу тугоплавких и легкоплавких металлов. Первым, чтобы превратиться в жидкость, нужно больше 2000 градусов Цельсия, вторым – меньше 500 градусов.
К легкоплавким металлам обычно относят олово (232 °C), цинк (419 °C), свинец (327 °C). Однако у некоторых из них температуры могут быть еще ниже. Например, франций и галлий плавятся уже в руке, а цезий можно греть только в ампуле, ведь от кислорода он воспламеняется.
Самые низкие и высокие температуры плавления металлов представлены в таблице:
Источник
Температура плавления разных металлов в таблице
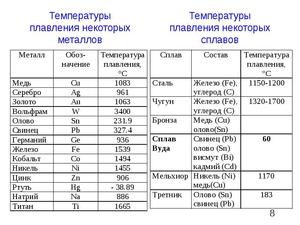
Самая высокая температура плавления среди металлов принадлежит вольфраму: она составляет 3422С о , самая низкая — у ртути: элемент плавится уже при — 39С о . Определить точное значение для сплавов, как правило, не представляет возможности: оно может значительно колебаться в зависимости от процентного соотношения компонентов. Их обычно записывают в виде числового промежутка.
Как происходит

При увеличении температуры увеличивается и амплитуда тепловых колебаний молекул, возникают структурные дефекты решетки, выражающиеся в росте дислокаций, перескоке атомов и других нарушениях. Это сопровождается разрывом межатомных связей и требует определенного количества энергии. В это же время происходит образование квази-жидкого слоя на поверхности тела. Период разрушения решетки и накопления дефектов называется плавлением.
Разделение металлов
В зависимости от температуры плавления металлы делятся на:
Легкоплавкие: им необходимо не более 600С о . Это цинк, свинец, виснут, олово.
- Среднеплавкие: температура плавления колеблется от 600С о до 1600С о . Это золото, медь, алюминий, магний, железо, никель и большая половина всех элементов.
- Тугоплавкие: требуется температура свыше 1600С о , чтобы сделать металл жидким. Сюда относятся хром, вольфрам, молибден, титан.
В зависимости от температуры плавления выбирают и плавильный аппарат. Чем выше показатель, тем прочнее он должен быть. Узнать температуру нужного вам элемента можно из таблицы.
Еще одной немаловажной величиной является температура кипения. Это величина, при которой начинается процесс кипения жидкостей, она соответствует температуре насыщенного пара, который образуется над плоской поверхностью кипящей жидкости. Обычно она почти в два раза больше, чем температура плавления.
Обе величины принято приводить при нормальном давлении. Между собой они прямопропорциональны.
- Увеличивается давление — увеличится величина плавления.
- Уменьшается давление — уменьшается величина плавления.
Источник
Температура плавления металлов. Самый тугоплавкий и легкоплавкий металл
Почти все металлы при нормальных условиях представляют собой твердые вещества. Но при определенных температурах они могут изменять свое агрегатное состояние и становиться жидкими. Давайте узнаем, какая температура плавления металла самая высокая? Какая самая низкая?
Температура плавления металлов
Большая часть элементов периодической таблицы относится к металлам. В настоящее время их насчитывается примерно 96. Всем им необходимы разные условия, чтобы превратиться в жидкость. Порог нагревания твердых кристаллических веществ, превысив который они становятся жидкими, называется температурой плавления. У металлов она колеблется в пределах нескольких тысяч градусов. Многие из них переходят в жидкость при относительно большом нагревании. Благодаря этому они являются распространенным материалом для производства кастрюль, сковородок и других кухонных приборов. Средние температуры плавления имеют серебро (962 °С), алюминий (660,32 °С), золото (1064,18 °С), никель (1455 °С), платина (1772 °С) и т.д. Выделяют также группу тугоплавких и легкоплавких металлов. Первым, чтобы превратиться в жидкость, нужно больше 2000 градусов Цельсия, вторым – меньше 500 градусов. К легкоплавким металлам обычно относят олово (232 °C), цинк (419 °C), свинец (327 °C). Однако у некоторых из них температуры могут быть еще ниже. Например, франций и галлий плавятся уже в руке, а цезий можно греть только в ампуле, ведь от кислорода он воспламеняется.
Самые низкие и высокие температуры плавления металлов представлены в таблице:
Самая высокая температура плавления — у металла вольфрама. Выше него по этому показателю стоит только неметалл углерод. Вольфрам представляет собой светло-серое блестящее вещество, очень плотное и тяжелое. Он кипит при 5555 °C, что почти приравнивается к температуре фотосферы Солнца. При комнатных условиях он слабо реагирует с кислородом и не подвергается коррозии. Несмотря на свою тугоплавкость, он довольно пластичен и поддается ковке уже при нагревании до 1600 °C. Эти свойства вольфрама используют для нитей накаливания в лампах и кинескопах электродов для сварки. Большую часть добытого металла сплавляют со сталью, чтобы повысить ее прочность и твердость. Широкое применение вольфрам имеет в военной сфере и технике. Он незаменим для изготовления боеприпасов, брони, двигателей и наиболее важных частей военного транспорта и самолетов. Из него также делают хирургические инструменты, ящики для хранения радиоактивных веществ.
Ртуть — единственный металл, температура плавления которого имеет минусовое значение. К тому же это один из двух химических элементов, простые вещества которых при нормальных условиях, существуют в виде жидкостей. Интересно, что кипит металл при нагревании до 356,73 °C, а это намного выше температуры его плавления. Имеет серебристо-белый цвет и ярко выраженный блеск. Она испаряется уже при комнатных условиях, конденсируясь в небольшие шарики. Металл очень токсичен. Он способен накапливается во внутренних органах человека, вызывая болезни головного мозга, селезенки, почек и печени. Ртуть – один из семи первых металлов, о которых узнал человек. В Средние века она считалась главным алхимическим элементом. Несмотря на ядовитость, когда-то ее применяли в медицине в составе зубных пломб, а также как лекарство от сифилиса. Сейчас ртуть почти полностью исключили из медицинских препаратов, но широко используют ее в измерительных приборах (барометрах, манометрах), для изготовления ламп, переключателей, дверных звонков.
Чтобы изменить свойства того или иного металла, его сплавляют с другими веществами. Так, он может не только приобрести большую плотность, прочность, но и снизить или повысить температуру плавления. Сплав может состоять из двух или больше химических элементов, но хотя бы один из них должен быть металлом. Такие «смеси» очень часто используют в промышленности, ведь они позволяют получить именно те качества материалов, которые необходимы.
Температура плавления металлов и сплавов зависит от чистоты первых, а также от пропорций и состава вторых. Для получения легкоплавких сплавов чаще всего используют свинец, ртуть, таллий, олово, кадмий, индий. Те, в составе которых находится ртуть, называются амальгамами. Соединение натрия, калия и цезия в соотношении 12%/47%/41% становится жидкостью уже при минус 78 °C , амальгама ртути и таллия — при минус 61°C. Самым тугоплавким материалом является сплав тантала и карбидов гафния в пропорциях 1:1 с температурой плавления 4115 °C.
Советуем подписаться на наши страницы в социальных сетях: Facebook | Вконтакте | Twitter | Google+ | Одноклассники
Источник
Глава IX. Жидкое «Серебро» и тяжелое «Серебришко» (Ртуть и платина)
Из записок алхимика, перевод Н. Морозова. («В поисках философского камня»)
Воинственный крест средневековья перечеркнул античную культуру. Водоворот истории захлестнул не только капители античных храмов вместе с населявшими их богами. Надолго ушли в небытие и вершины греческой и римской науки и искусства. Однако в ковчег человеческого благоразумия угодили все же некоторые из наиболее стойких достижений цивилизации. И в первую очередь семь классических металлов: золото, серебро, медь, железо, олово, свинец и ртуть»
С минералогией и историей освоения меди, золота, серебра, железа, свинца и олова мы уже несколько познакомились. «Серебряная вода»- ртуть — тоже была известна людям с давних пор. В таблице Менделеева, как вы помните, ртурь названа «гидраргирум», т. е. «жидкое серебро». Такое название дал ей еще в 1 в. н. э. греческий врач Диоскорид. И действительно, этот серебристый металл, единственный из примерно 80 металлов, известных на сей день, остается жидким при обычных условиях. Не просто жидким, но необычайно подвижным. Подвижность ртутных капель столь велика, что по-чешски ртуть так и называется «живая вода». Но если ртуть заморозить, то при температуре — 38,9°С она превратится в твердые, ромбические, очень тяжелые кристаллы синевато-серого цвета. Облик самого распространенного природного соединения ртути, ее сульфида — минерала киновари, резко отличается от привычного облика большинства других сульфидов, как правило, металловидных. Это темно-красные (брусничного оттенка) полупрозрачные кристаллы с алмазным блеском. Их форма — сплюснутые ромбоэдры или толстые трехгранные таблички, сросшиеся в плоские друзы. Но чаще киноварь слагает сплошные ярко-красные тонкозернистые массы или образует порошковатые налеты. Киноварь выпадает из водных растворов при сравнительно невысоких температурах; вместе с ней в месторождениях часто встречаются сульфид сурьмы — антимонит, сульфид цинка — сфалерит, сульфиды железа — пирит и марказит, а также минералы мышьяка — красный реальгар и золотой аурипигмент.
В зоне окисления месторождений при разложении киновари могут образоваться самородки — капельки самородной ртути. Благодаря пористости пород зоны окисления эти капельки стекаются и образуют значительные по размерам «лужицы» (о подобном явлении речь идет в рассказе И. А. Ефремова «Озеро горных духов», правда, целое озеро ртути — это уже вымысел фантаста).
С давних времен и по сей день киноварь является единственным промышленным рудным минералом ртути.
На одном из древнейших киноварных рудников — Никитовке на Украине — в горных выработках находили кайлы и молотки, сделанные из камня. Не менее древним считается ртутный рудник Хайдаркан в Ферганской долине (Средняя Азия). И здесь сохранились следы разработок: отвалы породы, глиняные светильники и реторты для обжига руд, в полуобвалившихся выработках — скелеты погибших здесь горняков (работа в ртутных рудниках была уделом рабов-смертников).
Киноварь
Крупнейшее в мире месторождение ртути — Альмаден — находится в Испании. По свидетельству Плиния Старшего, Рим ежегодно закупал в Испании до 4,5 т ртути. Вплоть до окончания второй мировой войны на долю Испании приходилось до 80% мировой добычи руд Жидкого Металла.
В древности из киновари, задолго до самой ртути, приготовляли яркую киноварно-красную краску. Но еще в античные времена было обнаружено главное свойство ртути — растворять металлы, даже такие стойкие, как золото и серебро. И не просто растворять. Медные предметы, покрытые таким раствором (амальгамой), после испарения ртути становились словно золотыми. Тончайший (всего в несколько микронов) слой позолоты накрепко прирастал к их поверхности. Так золотили шпили дворцов, купола церквей и соборов. В Петербурге в 1858 г. было завершено строительство гигантского сооружения — Исаакиевского собора. Диаметр колос-сального купола собора — 26 м. Свыше 100 кг червонного зрлота было нанесено на полированные медные листы при помощи ртутной амальгамы. История сохранила и еще одну цифру, страшную цифру — свыше 60 рабочих — позолотчиков погибли в мучениях, отравившись парами ртути.
И сейчас для золочения и серебрения различных изделий незаменимы ртутные амальгамы. Но техника безопасности при работе с этими чрезвычайно токсичными веществами шагнула далеко вперед.
Способность ртути растворять золото используется и для извлечения тончайшей пылевидной вкрапленности золота из коренных руд. Это же необыкновенное свойство в средние века способствовало превращению ртути в самое таинственное вещество — мать всех металлов, ведь золото, серебро, да и любой другой металл таял в ней и потом снова возрождался! Но раз есть мать, скорее всего должен быть и отец. Отцом всех металлов был признан сульфур — сера, ведь большинство металлов получают из сульфидов. Все в природе родится от отца и матери. Значит, именно соединение этих двух начал — матери металлов ртути и их отца серы — должно быть тем таинственным «философским камнем», который превращает в золото простые металлы.
Сульфид ртути — алая киноварь — вот чудесный и таинственный «философский камень» — так рассуждал крупнейший английский философ XIII в. и один из самых авторитетных алхимиков — Роджер Бэкон. Больше 20 лет провел Бэкон в темнице, в полном одиночестве. Туда по велению папы Клемента IV заточили его монахи-францисканцы, дабы никто другой не узнал тайны получения золота тогда, когда и сам Бэкон считал, что он совсем близок к важнейшему открытию, цели работ всех алхимиков. Бэкон написал в темнице трактат «Зеркало алхимии» — одну из самых обстоятельных книг о превращении металлов.
«При других условиях из Бэкона вышел бы Ньютон современной химии, а теперь в его лице мы видим Ньютона, из которого церковное самодержавие средних веков сделало больного мечтателя, истинного отца последующего алхимического направления в учении о строении вещества»- так писал об этом ученом другой ученый и революционер, узник Шлиссельбургской крепости Николай Морозов.
Где еще применяется ртуть и ее соединения сегодня?
Ртутная соль гремучей кислоты — гремучая ртуть — употребляется для изготовления детонаторов. Ртутно-кварцевые лампы — источник ультрафиолетового света, необходимого в медицине и технике. Трубочки люминесцентных ламп также заполнены разреженными парами ртути в смеси с аргоном.
Однако с тех пор, как был изобретен ртутный термометр, пожалуй, главная и наиболее ответственная работа ртути — определять температуру. Ртутные столбики в медицинских градусниках знакомы нам с детства, существуют еще и всевозможные лабораторные и технические термометры. Внутри тончайшей калиброванной капиллярной трубочки движущийся столбик дистиллированной ртути неуклонно и беспристрастно фиксирует температуру среды * , в том числе и температуру вашего тела. Но разбился градусник — и крошечные ртутные шарики разбегутся по полу, а собрать их, слить в большую каплю — очень трудно (пары ртути ядовиты, оставлять ее капли нельзя!).
* ( Если температура среды достигает -60°С, а то и -70°С, на помощь ртути приходит редкий металл таллий. Температуру воздуха на станциях Арктики и Антарктиды измеряют при помощи сплава ртути и таллия.)
Как вы помните, золото символизировало Солнце, серебро — Луну, медь — Венеру, железо алхимики посвящали Марсу, олово — Юпитеру, а свинец — Сатурну. Мать металлов — ртуть — за необычайную подвижность алхимики наградили символом Меркурия — самого подвижного, ловкого и деятельного римского божества. Ее называли седьмым завершающим классическую семерку металлом. Алхимики, как мы только что узнали, считали ртуть матерью всех металлов. В этом была своя логика. Ртуть так относится к металлу, как вода ко льду. Если вода — жидкий лед, то ртуть — жидкий металл, а уплотнить ее до предела — получится желанное золото — самый плотный из металлов, рассуждали они. Итак, рассуждали алхимики, на небе семь планет, а на Земле семь металлов и каждой планете соответствует свой металл, восьмого быть просто не должно!
Но от столь стройной гипотезы пришлось все же отказаться. Испанские корабли доставили с берегов колумбийской реки Рио-дель-Пинто еще одно, «странное» серебро, даже не серебро (по-испански «плата»), а так — «серебришко» — платину. Ее ценили в полцены серебра по массе! Платина из россыпей Рио-дель-Пинто оказалась воистину «бесовским порождением» — плотнее и тяжелее золота, да и расплавить ее не удавалось. И не мудрено! Температура плавления платины + 1773,5°С.
Когда выяснилось (честь этого открытия принадлежала фальшивомонетчикам), что тяжелую платину, в отличие от более легкого серебра, безнаказанно можно подмешивать в золото, привозить в казну стали не чистое, а платинированное золото. «Гадкий» «бесовский» металл, засоряющий королевскую казну, подвергся жестоким преследованиям испанской короны. В 1735 г. был издан королевский указ, повелевающий платину впредь в Испанию не ввозить. При разработке россыпей в Колумбии повелевалось тщательно отделять ее от золота и топить под надзором королевских чиновников в глубоких местах речки, теперь уже называвшейся Платино-дель-Пинто. А ту платину, которая уже привезена в Испанию, всенародно и торжественно утопить в море.
Только через 43 года король отменил этот закон, сообразив, что сам он тоже мог бы увеличить свою казну тем же способом! Но, увы, к тому времени не менее 4 т драгоценного металла было утоплено.
Освоить строптивый тугоплавкий металл удалось еще не скоро — ни одна из существовавших в то время печей не могла нагреть платину до температуры плавления. Обходной путь к обработке платины нашли в 1827 г. петербургские инженеры П. Г. Соболевский и В. В. Любарский, предложившие свой оригинальный способ обработки платины. Этот способ лег в основу современной «порошковой металлургии». При химической обработке руд металл приобретает вид серой пористой губки. Вот эту-то платиновую губку было предложено формовать под прессом при температуре + 1000° С. Результат получился великолепным форма отчеканивалась на металле идеально.
Приоритет в обработке платины позволил России стать пионером и в важной сфере применения платины как валютного металла. Смелая идея и детальный проект чеканки платиновой монеты принадлежали царскому министру финансов Е. Ф. Канкрину. Николай I милостиво согласился одобрить этот фантастический по тем временам, но очень уж соблазнительный для казны проект. Но при условии, если непоколебимый международный авторитет подтвердит его реальность. И авторитет нашелся. В лице эксперта предстал знаменитый немецкий географ и геолог, академик А. Гумболъдт. Гумбольдт специально совершил экспедицию на Алтай и Урал, оценил уральскую платину по достоинству и одобрил идею Канкрина. П. Г. Соболевскому была поручена труднейшая проблема технологии обработки металла, которую он успешно разрешил. И чеканные платиновые монеты увидели свет. Изобретенный в России способ обработки платины применяется и сегодня. С 1828 по 1845 г. в Петербурге чеканились платиновые монеты достоинством в 3, 6 и 12 рублей. Всего было отчеканено 1 млн. 400 тыс. рублей платиновых денег, на них пошло около 15 т платины. Однако со смертью энтузиаста платиновой валюты Канкрина чеканка прекратилась. Но с той поры платина навсегда вошла в малочисленную семью валютных металлов. Воскресили славу русской платиновой монеты уникальные платиновые рубли и червонцы, специально выпущенные к Московской Олимпиаде 1980 г.
Одна из загадок в истории освоения металлов состоит в том, что вождь ацтеков Монтесума еще в 1520 г. прислал в подарок испанскому королю полированные платиновые зеркала. Значит, индейцы доколумбовой Америки умели обрабатывать платину более чем за 300 лет до европейцев! А может быть, и раньше.
В природе платина, подобно золоту, сконцентрирована почти исключительно в самородном виде. Но облик самородной платины ускользающе неприметен. У нее словно нет надежных, «опорных» диагностических свойств: меняются оттенки цвета — серовато-серебристые, свинцово-серые, желтоватые, черноватые. Меняется блеск — то яркий, то тусклый. Не особенно характерна и форма зерен: встречаются и угловатые, и крючковатые, и чешуйки, и пластиночки, и мелкие округленные зернышки, и самородки. На Урале самородки платины достигают 8-9 кг. Одни из ее самородков своей гладкой поверхностью похожи на свинцовые слитки, а другие состоят из древовидных сростков мельчайших кристалликов, срастающихся в своеобразную губчатую массу. Изменчиво и такое обычно постоянное свойство, как магнитность: минерал бывает и сильно магнитным, и вовсе не магнитным. Единственно надежным признаком оставалась тяжесть. Воистину платина — «чадо тяжести»! Наконец, английский химик и минералог У. Х. Волластон всерьез занялся неоднородностью платины. Собрав коллекцию различных зерен платины, он тщательно классифицировал их и досконально изучил. Первое, что установил Волластон, звучало парадоксально: обычная самородная платина в чистом виде как раз и представляет наибольшую редкость! Кропотливо исследовал Волластон свою коллекцию. К 1805 г. он обнаружил еще один парадокс: платиной нередко считаются зерна, вовсе не содержащие этого элемента,- зерна осмистого иридия (вскоре из этих зерен оба элемента осмий и иридий и были извлечены впервые). Но преобладающая масса металловидных серых зернышек все еще не поддавалась пониманию исследователя, их свойства все еще оставались расплывчатыми. Колебался даже их химический состав: 80-85% платины, 7-15% железа, а остальное палладий, иридий, родий, никель, медь, свинец в самых разных соотношениях.
И тут Волластона осенила смелая догадка: несмотря на все различия, все разновидности представляют единый минерал, но это не просто минерал-металл, это минерал-сплав! Природный сплав платины и железа со множеством мелких примесей! Оттого так колеблются его свойства: изменчивость и есть их постоянное свойство! За смешанный непостоянный состав Волластон назвал обычную природную разновидность платины поликсен (с греческого это означает «много чужих»). Очень уж многопримесным оказался наиболее распространенный в природе платиновый сплав. Сегодня, помимо пяти главных минералов платиновой группы: ферроплатины, палладистой платины, поликсена, самородного палладия и осмистого иридия, известно еще множество более редких. Это в первую очередь платинистый иридий, иридистый осмий — невьянскит, сысертскит (название по г. Невьянску и реке Сысерть), потарит (HgPt). О том, что платина придает золоту сероватый оттенок, делает его «гнилым», знали еще испанские фальшивомонетчики времен покорения Америки испанцами. Но только в 1845 г. в россыпях Бразилии на месторождении Порпец было найдено природное «гнилое золото» — порпецит (палладистое золото). На острове Борнео и в Закавказье было выявлено платинистое золото, иридистое и родистое золото. Существует и минерал ауроосмирид, в нем 52% иридия, 25% осмия и 19% золота.
Последние десятилетия развеяли легенду об абсолютном «благородстве» платины: минералоги открыли, что незначительная часть этого благородного металла и металлов платиновой группы все же концентрируется в природных процессах в соединениях мышьяка (сперрилит), серы (куперит), сурьмы (стибиопалладинит), висмута (монгенит). А также в виде сульфидов, антимонидов, арсенитов.
Но все же главной формой ее концентрации и по сей день признается поликсен. Приурочена вкрапленность поликсена к ультраосновным породам. Здесь она встречается вместе с хрометом, оливином и хромдиопсидом.
Платина обладает замечательным сочетанием свойств. По химической стойкости она не уступает золоту. Ее электро- и теплопроводность лишь чуть меньше, чем у серебра. А по твердости, механической прочности и жаропрочности она далеко превосходит все остальные благородные металлы. Эти свойства позволяют широко применять платину и ее сплавы в современной технике.
Одна из классических почетных «профессий» платины — служба в палате мер и весов. В 1789 г. одним из первых декретов революционного правительства Франции было решение ввести твердую метрическую систему. В качестве единицы длины авторитетная комиссия геометров, географов, геодезистов постановила считать метр — одну десятимиллионную часть четверти длины Парижского географического Меридиана. В 1797 г. был изготовлен первый платиновый эталон метра -«архивный метр». Рядом с ним в архиве воцарилась гиря — платиновый цилиндр, эталон массы одного кубического дециметра воды (при +4°C) из реки Сены. Тираж «главных» метров (31 штука) и «главных» килограммов (40 штук) в дальнейшем был в точности воспроизведен в платиноиридиевом сплаве (иридий еще более повышает такое важное для «эталонов» свойство, как стабильность и стойкость против коррозии) и доставлен в различные страны.
Платиновый метр, правда, в последние годы уступил свой важный пост оранжевому лучу криптона * и перебрался на жительство в исторический музей. Но «главный» килограмм — платиноиридиевая цилиндрическая гиря уже больше века блестяще справляется со своей ролью, сверкая в темноте сейфа Ленинградского всесоюзного научно-исследовательского института метрологии имени Д. И. Менделеева.
* ( В 1960 г. за эталон метра была принята длина, равная 1650763,73 длины волны оранжевого излучения атома изотопа криптона-86.)
Служба мер и весов — лишь одна из многих, выполняемых платиной и ее сплавами. Достаточно вспомнить фильеры — колпачки с мельчайшими дырочками, сквозь которые продавливаются нити синтетической пряжи, тигли для выращивания рубинов для лазерной техники, ответственные электроконтакты, детали химической аппаратуры и хирургические инструменты.
Необыкновенным свойством отличаются стекла с тончайшим слоем платины — односторонней прозрачностью, т. е. с освещенной стороны они выглядят как обычное зеркало, а с теневой — совершенно прозрачны.
Важное и ответственное применение нашли сплавы платины с иридием в медицине: «. из сплавов платины с иридием были изготовлены зажимы электродов электрических стимуляторов сердечной деятельности. Электроды вживляются в сердце человека, страдающего стенокардией; в теле больного находится и крохотный приемник, присоединенный к электродам и генератору с кольцевой антенной. Как только начинается приступ стенокардии, больной включает генератор. Поступающие при этом в кольцевую антенну импульсы передаются в приемник, из него — на электроды, а затем через платиноиридиевые зажимы — на нервы, которые заставляют сердце работать активнее».
Тяжелая платина и легчайший бензин — что общего может быть между ними? Оказывается, платина способствует получению высококачественного бензина. В процессе расщепления нефтей на различные углеводороды и в дальнейшем, при получении высокооктановых бензинов, применяются катализаторы из сплавов платины. Каталитические свойства металлов платиновой труппы используются и при получении азота — важнейшего компонента азотных удобрений.
Низкие концентрации платины в месторождениях, трудоемкость добычи, конечно, затрудняют ее применение в технике, однако новая технология открывает перед платиной все новые и новые горизонты.
Источник


 Легкоплавкие: им необходимо не более 600С о . Это цинк, свинец, виснут, олово.
Легкоплавкие: им необходимо не более 600С о . Это цинк, свинец, виснут, олово.