Скорость таяния льда зависимость от температуры
Степан решил провести опыт с таянием льда. Он достал из морозильника одинаковые кусочки льда, приготовленные с помощью специальной формы, и положил несколько кусочков в кастрюлю с холодной водой и столько же кусочков в кастрюлю с таким же количеством горячей воды. Через некоторое время лёд в горячей воде растаял. Позже растаял лёд в холодной воде.
Если бы Степан хотел выяснить, зависит ли скорость таяния льда, погружённого в воду, от количества этой воды, с помощью какого опыта он мог бы это сделать? Опиши этот опыт.
Степан решил провести опыт с таянием льда. Он достал из морозильника одинаковые кусочки льда, приготовленные с помощью специальной формы, и положил несколько кусочков в кастрюлю с холодной водой и столько же кусочков в кастрюлю с таким же количеством горячей воды. Через некоторое время лёд в горячей воде растаял. Позже растаял лёд в холодной воде.
Сравни условия таяния льда в разных кастрюлях в описанном опыте. Подчеркни в каждой строке одно из выделенных слов.
Количество кусочков льда: одинаковое / различное
Количество воды в кастрюлях: одинаковое / различное
Температура воды в кастрюлях: одинаковая / различная
| Количество кусочков льда: | Количество воды в кастрюлях: | Температура воды в кастрюлях: |
Для выполнения данного задания нужно внимательно прочитать условия опыта и найти в них правильный ответ.
Степан решил провести опыт с таянием льда. Он достал из морозильника одинаковые кусочки льда, приготовленные с помощью специальной формы, и положил несколько кусочков в кастрюлю с холодной водой и столько же кусочков в кастрюлю с таким же количеством горячей воды. Через некоторое время лёд в горячей воде растаял. Позже растаял лёд в холодной воде.
Ответ: Количество кусочков льда одинаковое. Количество воды в кастрюлях одинаковое. Температура воды в кастрюлях различная.
Источник
Скорость таяния льда зависимость от температуры
Физико-химические основы плавления льда и эффективность противогололедных реагентов
Скорость таяния льда зависит от толщины слоя, его однородности, от погодных условий. Толщина льда варьируется от едва видимой пленки, образованной при понижении температуры на мокрой поверхности дорожного покрытия, до толстого слоя льда, образованного при замерзании талой воды и снега. Химическая формула и воды, и льда ? Н2О, но структура воды и льда различается наличием водородных связей. Структура жидкой воды представляет собой нарушенный тепловым движением тетраэдрический каркас, пустоты которого частично заполнены молекулами воды. Такая структура называется льдоподобной. Каждая молекула воды в составе льдоподобного каркаса образует одну зеркально- симметричную (прочную) и три центрально-симметричные (менее прочные) связи. Первая относится к связи между молекулами воды соседних слоев и остальные к связям между молекулами одного слоя.
Молекула воды состоит из атомов водорода и кислорода, связанных между собой химической ковалентной связью. В свою очередь молекулы воды взаимодействуют друг с другом и связаны водородной связью, что придает воде плотность. Чем больше водородных связей, тем выше плотность воды. Наибольшей плотностью 1 г/см3 вода обладает при температуре 4°С и нормальном давлении. Лед благодаря пустотам в кристаллической решетке имеет плотность меньше плотности воды. Удельная плотность льда равна 0,92 г/см3. Структуру воды можно представить в виде формулы:
где — — — водородная связь (энергия связи О — — — Н 21 кДж/моль),
—— ковалентная (химическая) связь (энергия связи О——Н 456 кДж/моль)
Фазовое состояние воды зависит от количества в ее структуре водородных связей. В случае, когда связи полностью разорваны, вода находится в парообразном состоянии, при температуре 0°С разорванных водородных связей в жидкой воде 15%, если разорванных связей нет, то вода находится в твердом состоянии (лед).
Вода является одним из самых распространенных растворителей. При растворении солей (NaCl, CaCl 2 и др.) в воде происходит сольватация ионов, т.е. электролитическая диссоциация солей по уравнениям:
NaCl + вода -> Na + + Cl —
CaCl2 + вода -> Ca ++ + 2Cl —
Эти процессы сопровождаются тепловыми явлениями и протекают до наступления динамического равновесия при данной температуре воздуха
Ионы кальция или натрия взаимодействуют с молекулами воды и занимают водородные связи, так как ионы и кальция, и натрия более электроотрицательны, чем ионы водорода. При этом нарушается структура воды (льда):
 |  |
На основании этого делается вывод, что хлористый кальций в два раза эффективнее, чем хлористый натрий при низких температурах. Здесь следует напомнить, что молекулярная масса хлористого натрия 58,5, а молекулярная масса хлористого кальция 111, и простой расчет показывает, что необходимые две молекулы NaCl равнозначны по расходу препарата одной молекуле CaCl 2 .
При растворении нелетучего вещества в воде относительное давление пара воды над раствором уменьшается, что вызывает повышение температуры кипения и понижение температуры замерзания по сравнению с чистой водой. Причем, чем выше концентрация раствора, тем меньше упругость пара.
По закону Рауля в разбавленных растворах не электролитов при постоянной температуре понижение давления пара пропорционально количеству вещества, растворенного в данном весовом количестве растворителя.
Dtз = kз С, где С — концентрация, выраженная в числе молей, растворенных в 1000 г растворителя, kз — коэффициент пропорциональности, зависящий от природы растворителя, для воды kз = 1,86.
,
где M — молекулярная масса вещества,
m — масса вещества, г.
Следовательно, при растворении в 1000 г воды одного моля вещества, температура замерзания снижается на 1,86°С. Закон Рауля применим только к идеальным и очень разбавленным растворам.
Dtз электролитов и концентрированных растворов практически всегда больше, например, при растворении 1 моля любого неэлектролита изменение температуры всегда равно 1,86°С, при растворении 1 моля хлористого натрия температура замерзания понижается на 3,36°С (по расчету 1,86ґ2=3,72), а 1 моля хлористого кальция примерно -8°С (по расчету 1,86ґ3=5,58). В настоящее время это объясняется увеличением количества сольватированных ионов за счет диссоциации. Ионы рассматриваются как отдельные частицы вещества.
Теплота растворения солей складывается из теплот двух процессов гидратации ионов и растворения. Растворение идет с поглощением тепла (процесс эндотермический), а гидратация с выделением (процесс экзотермический).
Процесс таяния льда протекает с поглощением тепла. Количество теплоты плавления льда Qпл = m l , где
l — удельная теплота плавления. для воды l = 1,4 ккал/г или 80 кал/моль.
m — масса льда.
При попадании противоголодедного препарата (соли) на поверхность льда, его частицы сначала должны раствориться с образованием рассола, который имеет температуру замерзания ниже температуры замерзания воды. Именно раствор соли, пока его концентрация такова, что температура его замерзания ниже температуры плавления льда, растапливает лед. Следовательно, скорость таяния льда и снега зависит от скорости растворения солей и эвтектической температуры растворов.
Скорость таяния снега или льда в соляном растворе зависит от диффузии ионов из концентрированного соляного раствора в менее концентрированный. Коэффициент диффузии зависит от концентрации соли, подвижности ионов, температуры.
На рисунке 3 и в таблице 1 приведены справочные данные по растворимости хлоридов натрия, кальция, калия и магния в зависимости от температуры. Знаком (*) отмечены концентрации и температуры, соответствующие точке эвтектики для каждой соли.
Таблица 1. Температура замерзания растворов противогололедных реагентов
Температура замерзания, °С
Температура замерзания раствора зависит от его концентрации. Снижение температуры замерзания идет до достижения раствором точки эвтектики. При понижении температуры кристаллизуется чистый растворитель, т.е. выделяются кристаллы льда, следовательно, повышается концентрация соли в растворе и соответственно понижается температура замерзания, при дальнейшем понижении температуры снова выделяются кристаллы льда и повышается концентрация соли. В момент достижения точки эвтектики совместно с кристаллами льда выделяются кристаллы соли, смесь которых и называется эвтектикой. Хлористый натрий достигает точки эвтектики при концентрации раствора 23,3 % (-21,2°С), хлористый кальций — при концентрации 29,5 % (- 51°С), хлорид магния с концентрацией 21,0 % (-33,5°С), ацетат калия — 50% (- 60°С). При дальнейшем росте концентрации солей температура кристаллизации повышается, в твердую фазу выделяются кристаллы соли. В процессе плавления льда растворы хлоридов разбавляются, концентрация падает. Разбавленные растворы имеют температуру замерзания выше, чем концентрированные и могут замерзнуть, вызывая дополнительную скользскость. Поэтому на практике хлористый натрий рационально использовать при температуре воздуха до -12°С, хлористый кальций — до -34°С
Процесс растворения кристаллов NaCl идет с поглощением тепла и протекает очень медленно. Кристаллу соли, помещенному на сухую поверхность, первоначально необходимо накапить тепловую энергию из окружающей среды до момента, пока на поверхности кристалла не образуется жидкая пленка. Образовавшийся раствор активизирует растворение оставшейся соли. Под действием собственного веса и при относительно медленной степени растворимости отдельные частицы хлористого натрия проникают через слой льда на поверхность дорожного покрытия, что, в результате, ослабляет связь между дорожным полотном и слоем льда. Рассол, образующийся вокруг этих частиц, растекаясь по дорожному покрытию, отслаивает лед от дорожного покрытия. После того как кристалл растворится, он продолжает накапливать тепловую энергию. Такой процесс с поглощением тепла называется эндотермической реакцией.
Влага или жидкость, находящаяся на дорожном покрытии, может ускорить процесс растворения. Жидкость можно распылять непосредственно на дорожное полотно или добавить ее к соли, до того как она будет внесена на поверхность льда, т.е. предварительно увлажнить хлористый натрий водой или раствором хлористого кальция.
Растворение хлористого кальция происходит значительно быстрее, чем растворение хлористого натрия. Причина в том, что хлористый кальций одновременно гигроскопичен и растворим в поглощенной из воздуха влаге (CaCl 2 при температуре воздуха от 0°С до -9°С абсорбирует влагу уже .при относительной влажности 42 % и выше, в то время как NaCl начинает абсорбировать влагу только при относительной влажности 76 % и выше). Таким образом, хлористый кальций в твердом состоянии абсорбирует влагу до тех пор, пока не растворится. Рассол будет продолжать абсорбировать влагу до тех пор, пока не будет достигнуто равновесие между упругостью паров раствора и упругостью паров воздуха. Если влажность воздуха повышена, то раствор абсорбирует больше влаги. Если влажность пониженная, то вода будет испаряться из раствора. Во время растворения хлористого кальция выделяется большое количество тепла. Такой процесс с выделением тепла называется экзотермическим. Известно, что с большим выделением тепла идет процесс образования гидратов (гидротация). Молекула хлористого кальция присоединяет 6 молекул воды с образованием кристаллогидрата CaCl 2 6H2O. Растворение кристаллогидрата идет с поглощением тепла. Например, при растворении 1 моля безводного хлористого кальция выделяется 17,4 ккал, при растворении 1 моля шестиводного кристаллогидрата поглощается 4,3 ккал. Следовательно, теплота гидратации хлористого кальция равна 21,7 ккал, (17,4+4,3=21,7)
Использование хлористого кальция для борьбы с зимней скользкостью ограничивается температурой ?34°С. Благодаря большой скорости растворения, меньшее количество хлористого кальция затрачивается в период снегоуборочных работ .
Сравнение термодинамических характеристик противогололедных препаратов приведено в таблице 2.
Таблица 2. Сравнение термодинамических характеристик противогололедных препаратов.
Источник
Лед тает
В этой статье блога Вольных Ледорубов речь пойдет о природе таяния льда. Почему лед тает, каким образом, при каких условиях и с какой скоростью?
Как известно, вода в окружающей нас среде находится в трех ипостасях – в виде жидкости, в виде пара, и в виде твердого тела (иначе говоря, льда), при этом вода может свободно переходить из твердого агрегатного состояния в жидкое, из жидкого в газообразное, и наоборот, всегда возвращаясь к исходным свойствам.
Нуль градусов по шкале Цельсия (0°С), при условии нормального атмосферного давления в 1 атмосферу (760 мм ртутного столба), является температурным значением фазового перехода воды из жидкого состояния в твердое (кристаллы льда) и, наоборот, из твердого в жидкое. Получается, что при постоянной нулевой температуре вода может быть как льдом, так и жидкостью, а вопрос кристаллизации или таяния заключается лишь в том, в какой начальной фазе состоит вода и какое на нее оказывается воздействие. В этой температурной точке лед продолжает оставаться льдом, а жидкость – жидкостью, если, соответственно, температура окружающего воздуха не поднимется выше нулевой отметки или не опустится ниже нее. В противном случае происходит теплообмен. То есть, нагревание льда при нуле градусов приводит к тому, что его температура уже не повышается – затраченное тепло уходит на разрушение кристаллической структуры льда, а после того, как весь лед растает и станет жидкостью, дальнейшее нагревание обусловит повышение температуры воды. В процессе замерзания дело обстоит ровно наоборот – с понижением окружающей температуры ниже нуля вода кристаллизуется, высвобождая при этом то количество энергии (тепла), которое необходимо для таяния того же объема льда.

Говоря о таянии льда или кристаллизации жидкой воды, стоит учесть некоторые существенные факторы, влияющие на эти процессы.
Как было уже отмечено, и для первого, и для второго фазового перехода важным условием является давление. Для большинства веществ характерно то, что при фазовом переходе увеличение давления способствует увеличению температуры нагревания. Высокое давление приводит к тому, что атомы вещества начинают уплотняться, соответственно кристаллическая решетка сжимается, следовательно, на ее разрушение требуется больше энергии. Однако в случае с водой зависимость температуры от давления выглядит иначе. Вода, замерзая, превращается в твердое тело (лед), но в отличие от многих веществ, при затвердевании она не уменьшается, а, наоборот, увеличивается в объеме примерно на 9%. Плотность льда меньше плотности воды в жидком виде, при 0°С у льда она составляет 916.7 кг/м3, а у воды – 999.8 кг/м3 (вот почему лед и не тонет в воде), а значит, увеличение давления способствует ускорению перехода воды из твердого состояния в жидкое, что в свою очередь приводит к снижению температуры плавления льда. Например, чтобы снизить температуру плавления льда на 1°С нужно увеличить давление боле чем на 100 кгс/см2 (килограмм-сила/кв.см) или 10 МПа (мегапаскалей).
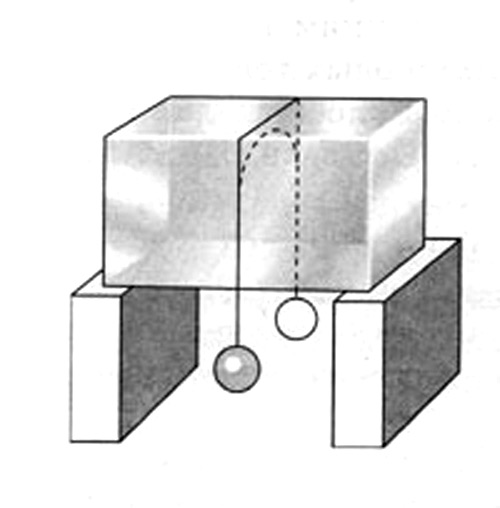
Зависимость температуры плавления льда от давления
Наглядно зависимость температуры плавления льда от давления можно увидеть на опыте. Через ледяной блок перекидывается нейлоновая нить, а к концам нити привязываются грузы; под давлением нити лед подтаивает, нить опускается, а образовавшаяся вода следом за нитью обратно замерзает. Таким образом, нить постепенно проходит сквозь лед, а сам ледяной блок в то же время остается целым.
Важным условием для образования льда является содержание в воде мельчайших взвесей, которые будут в данном случае являться ядрами ледяных кристаллов (о формировании ледяных кристаллов Вы также можете прочесть в статье « Микроледяные скульптуры »).
Дистиллированная же вода, очищенная от всяких примесей, может оставаться жидкостью и при отрицательной температуре, так как молекулам воды не за что будет зацепиться, чтобы создать кристаллическую решетку, но только в том случае, когда на воду не оказывается воздействие. А если же, к примеру, в сосуд с очищенной водой бросить кусок льда или бутылку с дистиллятом встряхнуть, процесс кристаллизации будет мгновенным, и за несколько секунд вода превратится в лед, благодаря пузырькам воздуха, микрочастицам, попавшим в воду, неровностям на поверхности сосуда.
Дистиллированная вода находясь на больших высотах в виде мельчайших капелек не замерзает даже при очень низких температурах, от -30 °С и ниже.
На фазовые переходы воды влияет также степень ее солености. Морская вода, в отличие от пресной, замерзает всегда при температуре ниже 0°С. Различие температур ее замерзания зависит от концентрации в ней солей, например, при 20%-ной солености температура замерзания составляет около -1°С, а при 40%-ной – чуть выше 2°С.
Концентрация соли снижает и температуру плавления льда. Мы часто с вами видели, как заледенелые проезжие части и пешеходные дорожки посыпали солью. Так вот, соль соединяясь с крупинками верхнего слоя льда, благодаря механическому воздействию, оказываемому нашими ногами и колесами автотранспорта, а также солнечным лучам и ветру, вызывающим подтаивание ледяной корки, образует своего рода смесь. Температура плавления смесей всегда ниже, чем температура плавления отдельных веществ, поэтому лед на дорогах начинает таять незамедлительно. При таянии образуется соленый водный раствор, который помогает растопить лед дальше.
Источник