- Вода пар лед равновесие
- Тройная точка
- Нарушения равновесия в системе водяной пар—вода
- Зависимость упругости насыщения от температуры
- Две принципиальные возможности нарушения равновесия в системе пар—вода
- Тройная точка воды
- Содержание
- Одновременное сосуществование трёх фаз воды
- См. также
- Ссылки
- Примечания
- Полезное
- Смотреть что такое «Тройная точка воды» в других словарях:
Вода пар лед равновесие
Тройная точка
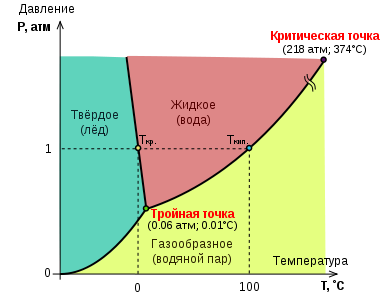
Итак, имеются условия, при которых пар, жидкость и кристалл могут попарно существовать в равновесии. Могут ли находиться в равновесии все три состояния? Такая точка на диаграмме давление — температура существует, ее называют тройной. Где она находится?
Если поместить в закрытый сосуд при нуле градусов воду с плавающим льдом, то в свободное пространство начнут поступать водяные (и «ледяные») пары. При давлении паров 4,6 мм рт. ст. испарение прекратится, и начнется насыщение. Теперь три фазы — лед, вода и пар — будут в состоянии равновесия. Это и есть тройная точка.
Соотношения между различными состояниями наглядно и отчетливо показывает диаграмма для воды, изображенная на рис. 4.11.
Такую диаграмму можно построить для любого тела.
Кривые на рисунке нам знакомы — это кривые равновесия между льдом и паром, льдом и водой, водой и паром. По вертикали, как обычно, откладывается давление, по горизонтали — температура.
Три кривые пересекаются в тройной точке и делят диаграмму на три области — жизненные пространства льда, воды и водяного пара.
Диаграмма состояния — это сжатый справочник. Ее цель — дать ответ на вопрос, какое состояние тела устойчиво при таком-то давлении и такой-то температуре.
Если в условия «левой области» поместить воду или пар, то они станут льдом. Если в «нижнюю область» внести жидкость или твердое тело, то получится пар. В «правой области» пар будет конденсироваться, а лед плавиться.
Диаграмма существования фаз позволяет сразу же ответить, что произойдет с веществом при нагревании или при сжатии. Нагревание при неизменном давлении изобразится на диаграмме горизонтальной линией. Вдоль этой линии слева направо движется точка, изображающая состояние тела.
На рисунке изображены две такие линии, одна из них — это нагревание при нормальном давлении. Линия лежит выше тройной точки. Поэтому она пересечет сначала кривую плавления, а затем, за пределами чертежа, и кривую испарения. Лед при нормальном давлении расплавится при температуре 0°С, а образовавшаяся вода закипит при 100°С.
Иначе будет обстоять дело для льда, нагреваемого при очень небольшом давлении, скажем, чуть ниже 5 мм рт. ст. Процесс нагревания изобразится линией, идущей ниже тройной точки. Кривые плавления и кипения не пересекаются этой линией. При таком незначительном давлении нагревание приведет к непосредственному переходу льда в пар.
На рис. 4.12 эта же диаграмма показывает, какое интересное явление произойдет при сжатии водяного пара в состоянии, помеченном на рисунке крестиком. Сначала пар превратится в лед, а затем расплавится. Рисунок позволяет тут же сказать, при каком давлении начнется рост кристалла и когда произойдет плавление.
Диаграммы состояния всех веществ похожи одна на другую. Большие, с житейской точки зрения, различия возникают из-за того, что место нахождения тройной точки на диаграмме может быть у разных веществ самым различным.
Ведь мы существуем вблизи «нормальных условий», т. е. прежде всего при давлении, близком к одной атмосфере. Как расположена тройная точка вещества по отношению к линии нормального давления — для нас очень существенно.
Если давление в тройной точке меньше атмосферного, то для нас, живущих в «нормальных» условиях, вещество относится к плавящимся. При повышении температуры оно сначала превращается в жидкость, а потом закипает.
В обратном случае — когда давление в тройной точке выше атмосферного — мы при нагревании не увидим жидкости, твердое вещество будет прямо превращаться в пар. Так ведет себя «сухой лед», что очень удобно для продавцов мороженого. Брикеты мороженого можно перекладывать кусками «сухого льда» и не бояться при этом, что мороженое станет мокрым. «Сухой лед» — это твердый углекислый газ С02. Тройная точка этого вещества лежит при 73 атм. Поэтому при нагревании твердого СО2 точка, изображающая его состояние, движется по горизонтали, пересекающей только лишь кривую испарения твердого тела (так же, как и для обычного льда при давлении около 5 мм рт. ст.).
Мы уже рассказали читателю, каким образом определяется один градус температуры по шкале Кельвина, или, как требует сейчас говорить система СИ,- один кельвин. Однако речь шла о принципе определения температуры. Не все институты метрологии обладают идеальными газовыми термометрами. Поэтому шкалу температуры строят с помощью фиксированных природой точек равновесия между разными состояниями вещества.
Особую роль при этом играет тройная точка воды. Градус Кельвина определяют сейчас как 273,16-ю часть термодинамической температуры тройной точки воды. Тройная точка кислорода принята равной 54,361 К. Температура затвердевания золота положена равной 1337,58 К. Пользуясь этими реперными точками, можно точно отградуировать любой термометр.
Источник
Нарушения равновесия
в системе водяной пар—вода
Важную роль играют в атмосферных процессах фазовые переходы водяной пар—вода (испарение воды и конденсация пара) и водяной пар—лед (сублимация льда и конденсация пара в твердое состояние). Первопричиной этих фазовых переходов являются нарушения равновесия в системах водяной пар—вода и водяной пар—лед.
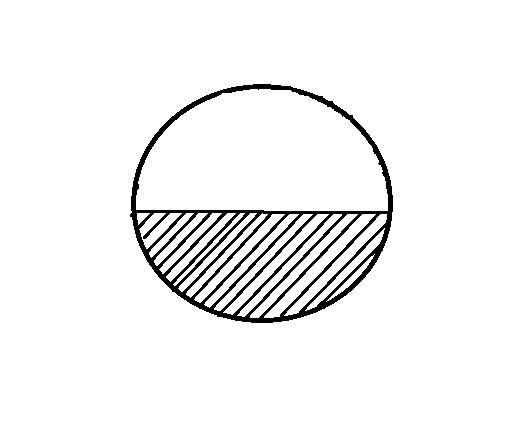
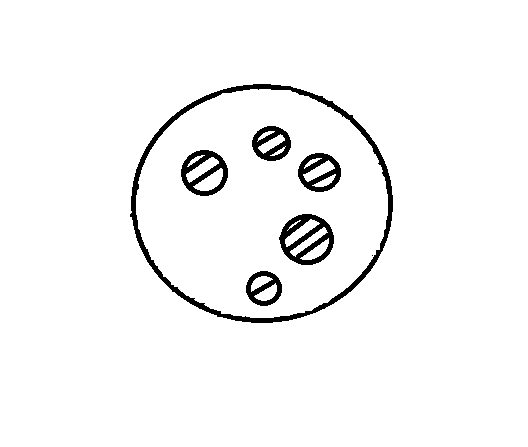
В природных условиях можем встретить систему водяной пар—вода, наблюдая, например, поверхность воды пруда или глядя на туман или облако. Обе системы схематично представлены на рис. Здесь условно выделен некоторый объем; внутри него одна часть оксида водорода находится в жидком состоянии, т. е. в виде воды (она заштрихована), а другая часть пребывает в газообразном состоянии, т. е. в виде водяного пара (она не заштрихована).
В случае, показанном на рис., а имеем дело с водяным паром в воздухе над плоской поверхностью воды; в случае, изображенном на рис., б — капли воды, взвешенные в воздухе, содержащем некоторое количество водяного пара. Конечно, кроме пара, в воздухе есть азот, кислород и ряд других газов, но в данной ситуации их можно не принимать во внимание. Их следовало бы учитывать (точнее говоря, следовало бы учитывать атмосферное давление), если бы в переходе вода —> пар участвовал процесс кипения воды. а б Рис.
Итак, отправимся мысленно на берег пруда. В отсутствие ветра водная гладь кажется совершенно спокойной. Но в
действительности перед нами совершается великое множество микрособытий, недоступных нашему взору. Наиболее быстрые молекулы Н20, преодолев притяжение со стороны других молекул, вылетают из водной массы и образуют пар над поверхностью воды. Это и есть испарение воды. Молекулы водяного пара сталкиваются с молекулами воздуха, и часть молекул Н20 возвращается обратно в жидкость. Это конденсация пара.
При данной температуре устанавливается своеобразное равновесие в системе пар—вода, когда число молекул Н20, покидающих за единицу времени жидкость, равно в среднем числу молекул Н20, возвращающихся за то же время обратно. Такое равновесие называют динамическим.
При наличии динамического равновесия процессы испарения и конденсации оказываются взаимно скомпенсированными. Водяной пар, находящийся в этом случае над поверхностью воды, называют насыщенным паром.
Можно сказать, что насыщенный пар — это пар, который находится в динамическом равновесии с водой, над которой он образовался.
При данной температуре насыщенный пар имеет определенное парциальное давление, иначе говоря, определенную упругость. Ее называют упругостью насыщенного пара или, проще, упругостью насыщения. Этим термином мы будем широко пользоваться; поэтому еще раз отметим: упругость насыщения есть парциальное давление насыщенного пара.
Если по какой-то причине упругость пара станет меньше упругости насыщения (например, если вдоль поверхности воды подует сухой ветер), то равновесие в системе пар—вода нарушится. Процесс испарения начнет преобладать над процессом конденсации. В результате упругость пара начнет расти. Это будет продолжаться, пока снова не установится динамическое равновесие между испарением и конденсацией; иначе говоря, пока пар снова не станет насыщенным.
Если упругость пара станет больше упругости насыщения (например, если над водой подует влажный ветер), то начнет преобладать процесс конденсации над процессом испарения. Упругость пара начнет уменьшаться пока не установится динамическое равновесие и пар не станет насыщенным.
Водяной пар, упругость которого меньше упругости насыщения при данной температуре, называют ненасыщенным или перегретым.
Пар, упругость которого больше упругости насыщения при данной температуре, называют пересыщенным.
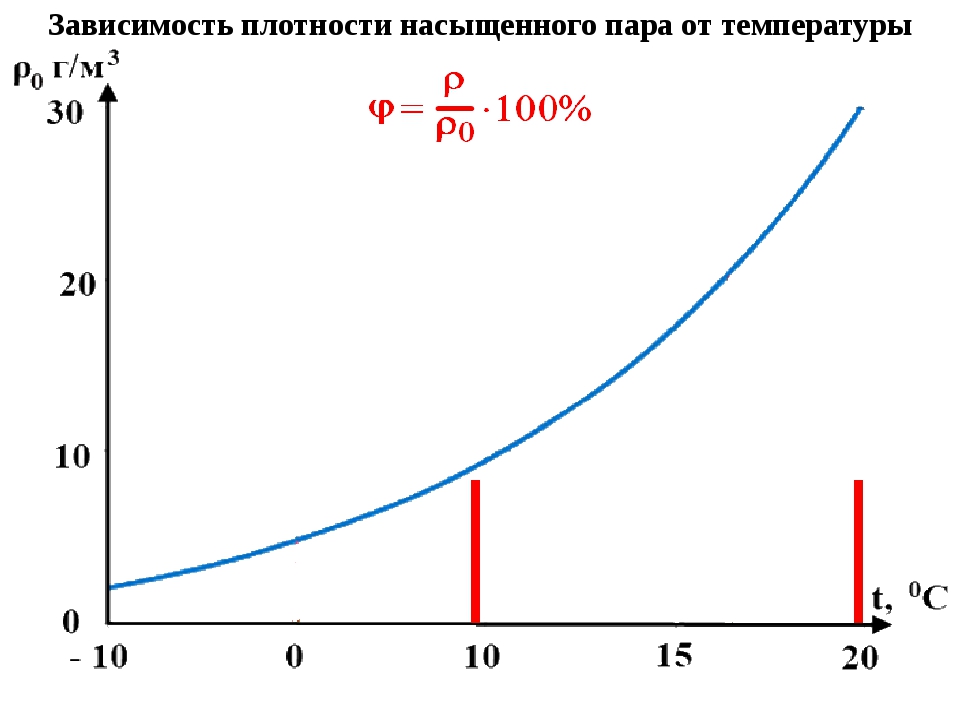
Зависимость упругости насыщения от температуры
Упругость насыщения монотонно возрастает с увеличением температуры. Причем возрастает не линейно, как того требует закон Шарля, а существенно быстрее, поскольку у насыщенного пара с ростом температуры возрастает не только кинетическая энергия молекул, но и их концентрация (за счет испарения).
Две принципиальные возможности нарушения
равновесия в системе пар—вода
Как мы уже выяснили, такие фазовые переходы, как испарение и конденсация, происходят при нарушении равновесия в системе водяной пар—вода, т. е. когда водяной пар отклоняется от состояния насыщения в соответствующую сторону.
Испарение происходит, когда пар становится ненасыщенным (перегретым), а конденсация — когда он становится пересыщенным. В равновесной системе пар—вода упругость пара равна упругости насыщения при данной температуре.
Легко сообразить, что существуют две принципиальные возможности нарушения равновесия в этой системе.
— Первая предполагает изменение упругости пара при неизменной упругости насыщения, т. е. при неизменной температуре. Если при этом упругость пара стала ниже упругости насыщения, возникает некомпенсированное испарение, а если упругость пара стала выше упругости насыщения, наступает нескомпенсированная конденсация.
— Вторая принципиальная возможность предполагает изменение температуры системы и, следовательно, упругости насыщения при неизменной упругости пара. Если при этом температура повысилась (а значит, упругость насыщения стала больше упругости пара), возникает нескомпенсированное испарение, а если температура понизилась
(упругость насыщения стала меньше упругости пара) — нескомпенсированная конденсация.
Разумеется, возможен и смешанный вариант — когда и упругость пара, и упругость насыщения изменяются. Если они изменяются одинаковым образом, равновесие системы пар—вода сохраняется. Оно нарушается, когда упругость пара и упругость насыщения изменяются различным образом (особенно если одна растет, а другая уменьшается). Испарение можно резко усилить, если одновременно понижать упругость пара (например, с помощью сухого ветра над водной поверхностью) и увеличивать упругость насыщения, повышая температуру. Конденсацию можно особенно усилить, если одновременно повышать упругость пара (например, с помощью влажного ветра над водой) и уменьшать упругость насыщения, понижая температуру. Понятно, что такие же соображения можно привести, рассматривая возможности нарушения равновесия в системе пар—лед.
Источник
Тройная точка воды
Тройна́я то́чка воды́ — строго определенные значения температуры и давления, при которых вода может одновременно и равновесно существовать в виде трёх фаз — в твердом, жидком и газообразном состояниях. Тройная точка воды — температура 273,16 К и давление 611,657 Па [1] .
Содержание
Одновременное сосуществование трёх фаз воды
Как видно из параметров тройной точки воды, при нормальных условиях равновесное сосуществование льда, водяного пара и жидкой воды невозможно. Это обстоятельство вроде бы противоречит обыденным наблюдениям — лёд, вода и пар часто наблюдаются одновременно. Но противоречия нет — наблюдаемые состояния далеки от термодинамически равновесных и реализуются на практике только из-за кинетических ограничений фазовых переходов. Тройная точка воды характеризуется определенным набором параметров давления и температуры, поэтому может иногда использоваться как «реперная» — то есть опорная, например, для калибровки приборов.
См. также
Ссылки
Примечания
- ↑Revised Release on the Pressure along the Melting and Sublimation Curves of Ordinary Water Substance. The International Association for the Properties of Water and Steam. Berlin, Germany, September 2008.
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое «Тройная точка воды» в других словарях:
тройная точка воды — (для элемента, представляющего собой разновидность сосуда Дьюара) [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN triple point of waterTPW … Справочник технического переводчика
Тройная точка — воды; p давление; t температура. ТРОЙНАЯ ТОЧКА, состояние равновесного сосуществования трех фаз вещества, обычно твердой, жидкой и газообразной. Температура тройной точки воды (точки сосуществования льда, воды и пара) 0,01°C (273,16 К) при… … Иллюстрированный энциклопедический словарь
ТРОЙНАЯ ТОЧКА — состояние равновесного сосуществования. Тройная точка воды трех фаз вещества, обычно твердой, жидкой и газообразной. Температура тройной точки воды (точки сосуществования льда, воды и пара, рис.) равна 0,01 .С (273,16 К) при давлении 6,1 гПа… … Большой Энциклопедический словарь
Тройная точка — точка на термодинамической диаграмме состояния, соответствующая равновесию трех фаз рассматриваемой термодинамической системы. Например, тройная точка воды соответствует равновесию системы, состоящей из льда, воды и водяного пара. Температуpa… … Энциклопедический словарь по металлургии
ТРОЙНАЯ ТОЧКА — точка на термодинамической диаграмме состояния, соответствующая равновесию трех фаз рассматриваемой термодинамической системы. Например, тройная точка воды соответствует равновесию системы, состоящей из льда, воды и водяного пара. Темпеpaтура… … Металлургический словарь
тройная точка — состояние равновесного сосуществования трёх фаз вещества, обычно твёрдой, жидкой и газообразной. Температура тройной точки воды (точки сосуществования льда, воды и пара, рис.) равна 0,01°C (273,16 К) при давлении 6,1 гПа (4,58 мм рт. ст.). * * * … Энциклопедический словарь
Тройная точка — Типичные виды фазовых диаграмм. Зелёная линия из точек показывает аномальное поведение воды Тройная точка точка на фазовой диаграмме, где сходятся три линии фазовых … Википедия
тройная точка — [tri pie point] точка на диаграммы состояния, соответствующая сосуществованию трех фаз вещества. Из правила фаз следует, что у химически индивидуального вещества (однокомпонентная система) при равновесии не может быть больше трех фаз. Эти три… … Энциклопедический словарь по металлургии
ТРОЙНАЯ ТОЧКА — в термодинамике, точка на диаграмме состояния, соответствующая равновесному сосуществованию трёх фаз в ва. Из Гиббса правила фаз следует, что химически индивидуальное в во (однокомпонентная система) в равновесии не может иметь больше трёх фаз.… … Физическая энциклопедия
ТРОЙНАЯ ТОЧКА — ТРОЙНАЯ ТОЧКА, температура и давление, при которых все три состояния вещества (твердое, жидкое, газообразное) могут существовать одновременно. Для воды тройная точка находится при температуре 273,16 К и давлении 610 Ра … Научно-технический энциклопедический словарь
Источник